每经编辑|何小桃
据新京报报道,美国食品和药品监督管理局(FDA)近日发布消息,以最高级别召回飞利浦旗下多款呼吸机产品。被召回的产品主要用于治疗阻塞性睡眠呼吸暂停综合征,因呼吸机故障警报装置失效,可能导致治疗中断或失败,还可能导致脆弱患者通气不足、低氧血症、高碳酸血症、呼吸衰竭或死亡。
经FDA确认,目前共有911起报告与召回事件有关,其中已有7人死亡。

致7人死亡
多款呼吸机被召回
根据报道,美国食品和药品监督管理局近日发布消息,飞利浦伟康公司更新了旗下多个呼吸机产品(BiPAP V30, BiPAP A30, BiPAP A40 )的使用说明。此举与其多个呼吸机产品召回有关。
早在今年3月份,飞利浦伟康公司向所有受到影响的客户发出紧急医疗器械召回通知。由于呼吸机故障警报装置故障,可能导致治疗中断或失败,飞利浦伟康公司正在更新V30、A30、A40呼吸机的使用说明,故障还可能潜在导致脆弱患者通气不足、低氧血症、高碳酸血症、呼吸衰竭或死亡。
本次召回涉及更新BiPAP V30, BiPAP A30, BiPAP A40设备的使用说明,并不包括将终止使用或不再销售这些产品。FDA已将此次召回确定为最高级别召回。如果不按照更新后的说明使用继续使用前述设备,可能导致严重受伤或死亡事件。
在进一步评估之后,FDA上周更新了与此次召回事件有关的伤亡人数,目前共有911起报告与召回事件(呼吸机故障报警装置失效)有关,其中包括894起故障,10人受伤,7人死亡。
前述呼吸机产品主要用于为患有阻塞性睡眠呼吸暂停及呼吸功能不全等其他疾病的成人和符合条件的儿童提供有创或无创支持,具体使用环境有所区别。
记者查询国家药监局网站数据库获悉,前述三个规格的呼吸机产品中,已有两款产品在国内获批。其中,型号规格为BiPAP A40的呼吸机产品于2023年6月12日批准(注册证编号:国械注进20192082053),另一款型号规格为BiPAP A30的呼吸机产品于2021年5月25日获批(注册证编号:国械注进20162085170),两款产品的注册人均为伟康股份有限公司(Respironics, Inc.),代理人均为飞利浦(中国)投资有限公司,产品适用范围/预期用途与FDA发布的内容相同。
就这两款呼吸机产品在国内的销售情况及是否同样存在故障警报装置失效、需要召回等问题,7月17日,记者向飞利浦发去采访提纲,对方表示回复需经总部审批,或在稍后晚些回应。

曾陷召回泥潭
作为全球医疗器械巨头的飞利浦,曾一度因召回事件陷入泥潭。
据澎湃新闻报道,飞利浦的“召回”风波是从2021年6月开始的。第一份召回通知涉及双水平气道正压通气 (bi-level PAP)、持续气道正压通气(CPAP)和机械呼吸机设备,涉及数量约300-400万台,因为它们存在与聚酯基聚氨酯(PE-PUR)隔音相关的潜在风险,设备中的泡沫成分可能会对人体产生危害。
2021年7月,FDA将该批次的召回确定为一级召回。一级召回是召回级别中的最高等级,指使用该医疗器械可能或者已经引起严重健康危害。据FDA的召回公告,如果用于消除呼吸机声音和震动的泡沫随时间的推移开始分解,可能会导致用户吸入碎片和未经测试的化学物质,进而引起头痛、外部和内部刺激、哮喘、恶心、对肾脏和肝脏等器官的毒性或致癌作用等症状。
随后,美国和加拿大提起多起集体诉讼,飞利浦开始对召回设备进行维修和更换。然而2022年1月,FDA将一级召回指定范围扩大到飞利浦呼吸设备,飞利浦在接下来的一年里又多次进行了多次呼吸设备的召回。
飞利浦呼吸机的召回危机波及中国。2022年6月,中国国家药品监督管理局接连发布2则通知,宣布召回飞利浦旗下的无创呼吸机和X射线计算机体层摄影设备共计28494台。
2023年4月,飞利浦又再次面临严重的召回,涉及其重新设计的DreamStation CPAP设备。2023年4月底,飞利浦详细更新了正在进行中的召回数据,据其介绍,4800份最近的投诉是在1-2月收到的,其他的1200份是在3月收到的。在报告中,飞利浦否认伤害和死亡事件是由泡沫分解引起的。“目前,飞利浦尚未发现将这些设备和死亡案例联系起来的数据。绝大多数的故障投诉不涉及严重的受伤或死亡。”该公司写道。
多次“召回”给飞利浦带来了巨大的影响。飞利浦公司2022年财报显示,2022年飞利浦净亏损为16.05亿欧元,上年同期净利润为33.23亿欧元;运营收入亏损15.29亿欧元,上年同期收入为5.53 亿欧元。该公司CFO Abhijit Bhattacharya表示,业绩不佳主要受到供应问题、疫情以及呼吸器召回事件带来的影响。
2022年,飞利浦在全球范围内进行了两次裁员,共计裁员1万人,其中第二次计划裁员6000人,约一半在2023年执行,其余将在2025年执行。2022年8月,飞利浦宣布,CEO万豪敦(Frans van Houten)将卸任,其职位由罗伊·雅各布斯(Roy Jakobs)接替,于2022年10月15日生效。雅各布斯已在飞利浦工作超过12年,2021年,他代表飞利浦负责解决呼吸设备召回问题。
今年1月,持续发酵三年半的飞利浦呼吸机召回事件,最终以多款产品退市收尾。
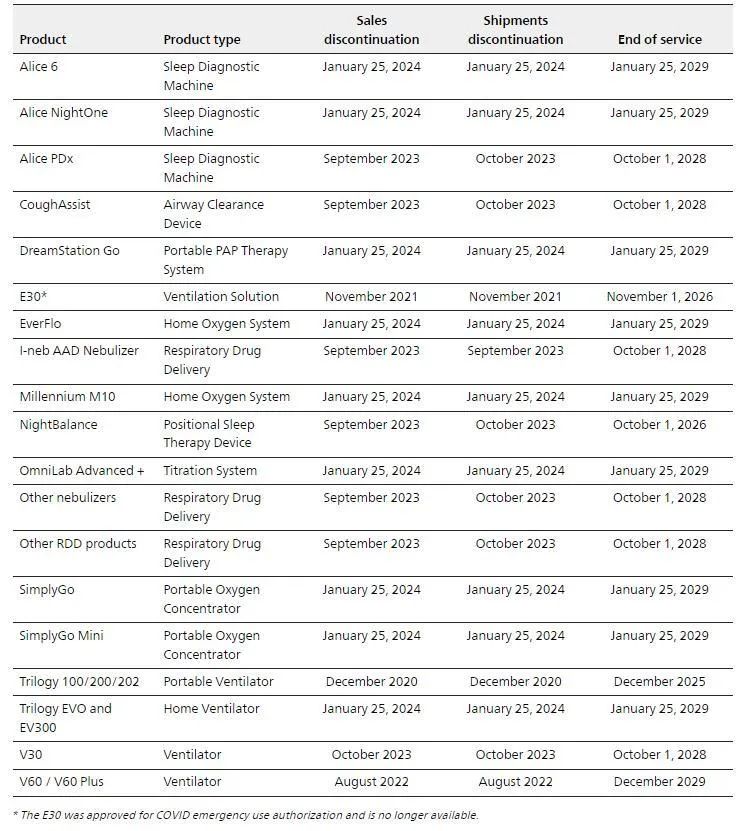
根据飞利浦官网的产品组合更新,在美国,飞利浦伟康将专注于包括面罩在内的耗材和配件的销售,而不再销售医院呼吸机产品、某些家用呼吸机产品、便携式和固定式制氧机以及睡眠诊断产品,其中自2024年1月25日起停售的产品多达9款。

飞利浦主动召回其旗下的
医用磁共振成像系统
另外,据新华网7月5日报道,近期,国家药品监督管理局(国家药监局)官网发布一则消息,飞利浦主动召回其旗下的医用磁共振成像系统(MRI),此次召回级别被定为一级召回,意味着使用该设备可能或已经导致严重健康危害。
根据国家药监局信息,飞利浦此次主动召回的医用磁共振成像系统涉及多个批次,包括国食药监械(进)字2012第3281132号、国食药监械(进)字2013第3284026号等产品,这些产品在中国市场共销售了129台。召回的主要原因是设备在使用过程中存在安全隐患,如磁体外壳与正交体线圈(QBC)外壳之间的密封条黏合剂可能失效,导致扫描床在进出系统磁体孔时可能对患者造成伤害。
据统计,在过去一年内,飞利浦在国家药监局官网上共公布了5次主动召回,包括医用磁共振成像系统、移动式C形臂X射线系统等多种医疗器械。其中,医用磁共振成像系统成为召回的重点。这些召回行动显示了飞利浦在发现产品缺陷后的积极态度和迅速响应。
值得注意的是,飞利浦的一级召回并非个例。在主动召回中,有多次被评定为一级召回,涉及医用磁共振成像系统、单光子发射及X射线计算机断层成像系统等产品,且这些产品均在国内有售。例如,今年1月,飞利浦因磁共振成像系统磁体外壳与QBC外壳间密封条问题,主动召回了多批次产品,这些产品在国内销售数量高达925台,主要流向公立医疗机构。
医疗器械召回制度是保障公众健康安全的重要手段,也是企业履行社会责任的体现。根据《医疗器械召回管理办法》,医疗器械召回分为一级、二级和三级三个级别,分别对应不同的健康危害程度。一级召回作为最高级别,要求企业在发现严重缺陷时立即采取行动,防止危害扩大。
医药界人士指出,对于飞利浦等知名企业而言,频发的召回事件不仅是对企业自身的一次考验,更是对整个医疗器械行业的一次警示。企业应当以此为契机,加强内部管理,提升产品质量,确保每一件产品都能安全有效地服务于患者。
编辑|何小桃 盖源源
校对|孙志成
每日经济新闻综合新京报、澎湃新闻、新华网等

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
