◎君实生物方面回应《掘金创新药》研究员称,FLAMES研究的期中分析结果表明,senaparib可显著延长晚期卵巢癌患者的无进展生存期(PFS),且不论患者的乳腺癌易感基因(BRCA)表达如何,患者均可获益。
◎研究员认为,CAR-T产品自获批以来,其可及性问题一直备受关注,各家药企在提高工艺、降低成本的同时,也在积极推进CAR-T产品向血液瘤以外领域的突破。从这一点上而言,药明巨诺与复星医药在自免领域的探索不谋而合。
每经记者|许立波 每经编辑|魏官红

《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
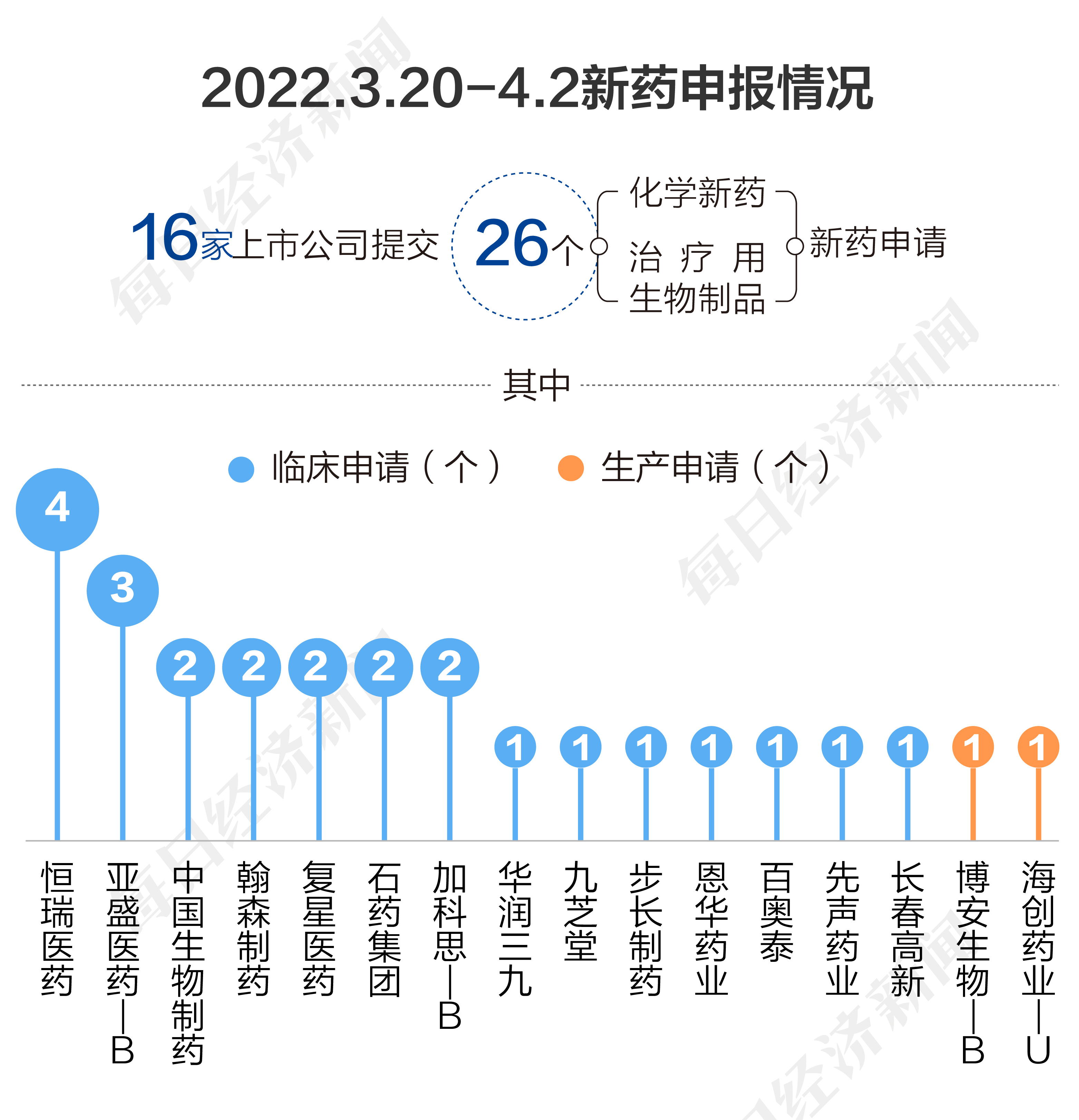
根据药渡数据,2023年3月20日至4月2日,国家药品监督管理局药品审评中心(CDE)共收到16家上市公司提交的26个化学新药、治疗用生物制品新药申请。
2023年3月20日至4月2日期间,上市公司方面,恒瑞医药提交4个临床申请;亚盛医药-B提交3个临床申请;加科思-B、石药集团、复星医药、翰森制药、中国生物制药各提交2个临床申请;长春高新、先声药业、百奥泰、恩华药业、步长制药、九芝堂、华润三九各提交1个临床申请。海创药业-U、博安生物-B各提交1个生产申请。
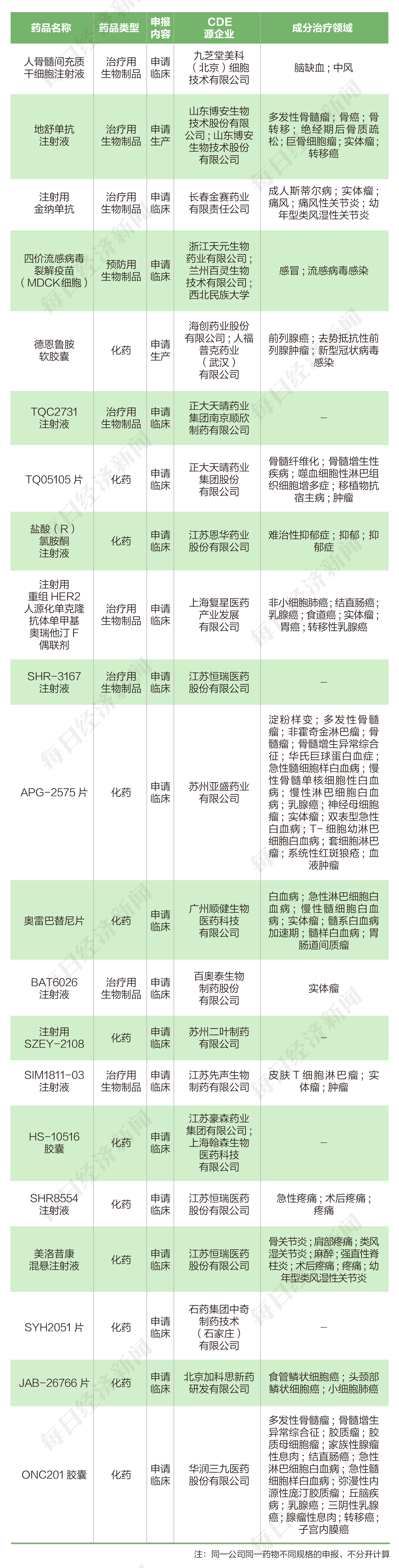
1、君实生物PARP抑制剂III期临床达到主要研究终点
2023年4月11日,君实生物公告称,公司与英派药业合作开发的聚腺苷二磷酸核糖聚合酶(PARP)抑制剂senaparib(产品代号:JS109/IMP4297)用于国际妇产科联盟(FIGO)Ⅲ-Ⅳ期上皮性卵巢癌、输卵管癌或原发性腹膜癌患者,对一线含铂化疗达到完全或部分缓解后维持治疗的随机、双盲、安慰剂对照、多中心III期临床研究(FLAMES研究,NCT04169997)已完成方案预设的期中分析。独立数据监查委员会(IDMC)判定研究的主要终点达到方案预设的优效界值。公司与英派药业将于近期与监管部门沟通递交该药品的新药上市申请事宜。
FLAMES研究是一项随机、双盲、安慰剂对照、多中心的III期临床研究,也是首个获得阳性结果的国产PARP抑制剂用于卵巢癌一线维持治疗III期临床研究。该研究旨在评价一线含铂化疗达到完全缓解(CR)或部分缓解(PR)后senaparib单药维持治疗FIGO III/IV期卵巢癌患者的有效性和安全性。
君实生物方面回应《掘金创新药》研究员称,FLAMES研究的期中分析结果表明,senaparib可显著延长晚期卵巢癌患者的无进展生存期(PFS),且不论患者的乳腺癌易感基因(BRCA)表达如何,患者均可获益。此外,君实生物方面还透露,该临床研究的详细数据将在今年下半年的学术会议上进行公布。
行业洞察:
卵巢癌是最常见的致死性女性生殖道恶性肿瘤之一。根据GLOBOCAN 2020数据,全球卵巢癌的年新发病例数约31万,每年死亡病例数约21万。由于卵巢癌早期症状隐匿且非特异,约80%的患者确诊时已为晚期,5年生存率仅有40%。
尽管卵巢癌经过初始含铂化疗后可以得到缓解,但大多数患者可能面临复发。近年来,PARP抑制剂正在改变卵巢癌的治疗格局,其维持治疗可延长一线含铂化疗后的缓解时间,延缓复发。
据弗若斯特沙利文报告,全球范围内PARP抑制剂市场增长迅速,2020年达到24亿美元,预计未来市场规模将以38.3%的复合年增长率增长,2025年达到123亿美元。在中国PARP抑制剂市场,预计将于2025年增长到约人民币147亿元。
从市场格局来看,据西南证券研报的梳理,截至2022年2月,全球范围内共批准6款PARP抑制剂获批上市,其中,中国获批的有4款,分别是阿斯利康的奥拉帕利(2018年)、再鼎医药从GSK子公司Tesaro处引进的尼拉帕利(2019年)、恒瑞医药和豪森药业联合开发的氟唑帕利(2020年)以及百济神州的帕米帕利(2021年)。
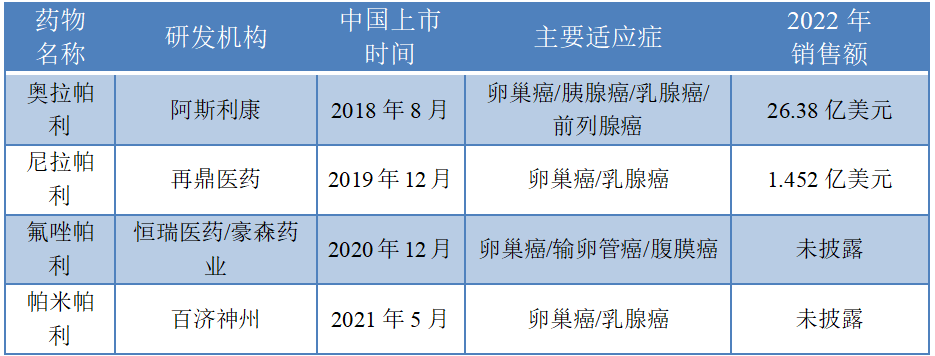
数据来源:据公开资料、企业年报等整理
2014年,全球首个PARP抑制剂奥拉帕利获批上市,伴随着多项适应症的获批,其销售额呈持续上升趋势。西南证券研报显示,在上市的PARP抑制剂中,奥拉帕利获批适应症最多,分别获批了输卵管癌、卵巢癌、腹膜癌、胰腺癌、乳腺癌、前列腺癌。2022年,奥拉帕利的全球销售额继续攀升,达到26.38亿美元(同比增长12%);其国内销售数据虽未明确披露,但根据米内网数据,2021年奥拉帕利中国市场医院终端+零售终端销售收入约为11.63亿元。
4月1日,据CDE官网,辉瑞甲苯磺酸他拉唑帕利胶囊递交上市申请已受理,他拉唑帕利是全球第4款(共6款)获批上市的PARP抑制剂,也是国内第5款申报上市的PARP抑制剂,其进度已领先君实生物一步。
《掘金创新药》研究员分析认为,目前国内PARP抑制剂竞争格局尚属良好,虽然阿斯利康的奥拉帕利占据先发优势,其余几家的PARP抑制剂在获批适应症数量、临床进展等方面暂难以与之抗衡,但考虑到再鼎医药的尼拉帕利在上市后销售额也在2021年(9357.9万美元)、2022年(1.452亿美元)呈现爆发式增长,这一成绩几乎与先一步在国内上市的奥拉帕利相差无几,或说明PARP抑制剂仍有巨大增量空间有待释放。
但需要注意的是,奥拉帕利化合物将于2024年3月到期,制剂专利在2029年10月到期,国内齐鲁制药、科伦制药、石药欧意等企业均已递交仿制药申请,上海迪诺、天士力、人福药业等多家企业也正在排队涌入PARP抑制剂市场,未来这一领域的竞争将逐渐激化。
公司点评:
3月30日晚间,君实生物发布2022年年度报告。报告期内,公司共实现营业收入14.53亿元,同比减少63.89%;归属于上市公司股东的净亏损约23.88亿元,同比扩大231.25%;基本每股收益亏损2.6元。
而这也是君实生物自2019年以来,营业收入首次出现负增长。对此,公司在年报中解释称,营收同比下降主要系上期公司基于与Eli Lilly and Company、Coherus的合作协议产生了大额技术许可收入和特许权收入,报告期内对应的技术许可收入及特许权收入减少。
从具体产品收入看,君实生物核心产品PD-1特瑞普利单抗(商品名:拓益)在国内市场实现销售收入7.36亿元,同比增长78.77%。
横向对比最近三年的财报,可以发现特瑞普利单抗的销售额经历了相当大的起伏。特瑞普利单抗自2018年底获批以来,其销售额经历一段时间的爬升后在2020年度达到高峰10.03亿元,而后由于医保降价、市场竞争激烈等原因,2021年,销售额遭遇腰斩,全年仅实现销售额4.12亿元,同比下降58.96%。2022年的销售情况则有了显著回暖,公司在年报中称,随着公司商业化能力提升,以及新增2项大适应症获批上市,特瑞普利单抗在国内市场的销售情况已逐步进入正向循环。
2、切入自免领域,药明巨诺CAR-T瑞基奥仑赛系统性红斑狼疮适应症获批临床
2023年4月10日,药明巨诺宣布,瑞基奥仑赛注射液(简称relma-cel)用于治疗中重度难治性系统性红斑狼疮(SLE)的新药临床试验申请(IND)已获得中国国家药品监督管理局的默示许可。
已发表在新英格兰医学杂志、自然医学杂志上的临床研究结果显示,靶向CD19的CAR-T细胞治疗SLE患者疗效显著。Relma-cel有望为中重度SLE患者提供一种全新的、安全有效的治疗选择。
药明巨诺称,上述研究是一项关于难治性系统性红斑狼疮成人患者的开放、单臂、多中心的I/II期研究。I期研究为剂量爬坡研究,旨在评估relma-cel的安全性、耐受性,并确定II期推荐剂量(RP2D)。作为扩展性研究的II期研究将应用RP2D治疗中重度难治性SLE患者,以确定relma-cel在中重度难治性SLE患者中的疗效与安全性,并评估药代动力学和药效学特征。
行业洞察:
据了解,系统性红斑狼疮是一种复杂的自身免疫性疾病,可引起全身多脏器和组织受损。据估算,目前中国约有100万名系统性红斑狼疮患者。近年来,系统性红斑狼疮患者的长期生存虽有所改善,但不可避免的疾病复发及其导致的不可逆的器官损伤仍是系统性红斑狼疮患者死亡的重要原因。系统性红斑狼疮患者的死亡率是普通人群的3至4倍。因此急需创新的治疗手段实现疾病症状的持续缓解,控制器官损害,改善患者长期生存。
瑞基奥仑赛注射液针对系统性红斑狼疮的适应症获批临床,意味着该CAR-T疗法在血液瘤之外,也开始切入自身免疫领域。平安证券研报指出,自身免疫疾病是由于机体免疫系统被错误导向攻击宿主自身所引发的疾病。正常情况下,人体免疫系统仅识别和清除外来或危险物质,然而,当功能出现异常,免疫系统可能会对自身组织的抗原产生自身免疫反应,并对其进行攻击,产生炎症和组织损伤,而慢性炎症或损伤将进一步导致自身免疫病。
截至目前,全球已发现超过100种自身免疫病,包括全身性免疫疾病和器官特异性免疫疾病,患者人数众多。据估计,全球约有7.6%~9.4%的人群患有自身免疫性疾病。中国目前自身免疫疾病发病率尚无确切数据,不过患者人群在逐年增加,其中较为常见的主要包括慢性鼻窦炎、特应性皮炎、哮喘、银屑病、类风湿关节炎等,患者规模较大,已经成为除心血管疾病和癌症外第三大慢性病。
从市场空间上看,由于自身免疫病难以治愈,同时病情反复持久,严重影响生活质量,因此患者通常具有较强的用药意愿,且需要长期甚至终身服药。考虑到巨大的患者基数以及长期高频的用药方式,自身免疫治疗赛道展现出良好的市场前景。有数据显示,2021年全球销售额TOP100药品的合计销售规模约4519亿美元,其中自身免疫药物为794亿美元,占比18%。
对于自免这一重要赛道,跨国药企也是动作频频。继辉瑞拟“豪掷”430亿美元收购ADC巨头Seagen一个月后,原本属意ADC赛道的默沙东也将眼光投向了自免领域,近日,其宣布拟以每股200美元、108亿美元的总金额收购生物科技公司Prometheus,这笔交易预计将于今年第三季度完成。通过此次收购,默沙东将获得Prometheus研发管线中一种有前景的溃疡性结肠炎和克罗恩病的实验性治疗方法,并扩大其在自免领域的影响力。
公司点评:
3月29日,药明巨诺发布2022财年年报。公司在报告期内实现营业收入1.46亿元,同比增长373.10%,归属母公司净亏损8.46亿元,亏损同比扩大20.48%。
财报披露,在过去一年,瑞基奥仑赛一共开具了165张处方,完成141例患者的回输。尽管与2021年的3079.7万元相比,销售业绩增长了373.1%,但其销售开支也由2021年的1.71亿元增加至1.91亿元,甚至高于其1.46亿元的营收。对此,药明巨诺表示,这主要由于员工成本增加,以及2022年全面开展商业活动以全力支持瑞基奥仑赛的商业化,令业务推广费增加。
国内上市的另一款CAR-T产品是复星凯特的阿基仑赛注射液,目前尚未有详细的销售数据披露。不过,据复星医药2022年年报,截至2023年1月末,阿基仑赛已治疗近300位复发或难治性大B细胞淋巴瘤患者。而在2021年年报中,复星医药曾披露,截至2022年2月末已有约百名患者进入CAR-T细胞治疗流程。按此计算,阿基仑赛的年处方量也只是稍多于瑞基奥仑赛,两者差距不大。
复星医药董事长吴以芳曾对《掘金创新药》研究员表示,目前,作为一种个性化药物,CAR-T的治疗费用依旧很高,怎么在现有基础上降低成本、提高患者的用药可及性依旧是一大方向。此外,接下来,如何拓宽CAR-T的市场应用前景也需要进一步关注,行业需要进一步在血液瘤的基础上探索实体瘤领域的发展可能。“复星医药也做了探索,并发现CAR-T不仅在肿瘤治疗上,实际上在一些免疫性疾病方面,也发现了非常可喜的一些进展和潜在的机会。”
研究员认为,CAR-T产品自获批以来,其可及性问题一直备受关注,各家在提高工艺、降低成本的同时,也在积极推进CAR-T产品向血液瘤以外领域的突破。从这一点上而言,药明巨诺与复星医药在自免领域的探索也就不谋而合。
需要引起警惕的是,CAR-T产品所处的CGT(细胞与基因治疗)赛道也存在发展不及预期的风险,尤其是2023年以来,就连国内CGT CDMO龙头药明康德也由于现实原因对其子公司药明生基临港生产基地做出了大量裁员、关闭生产线等业务调整。研发费用、生产成本高企导致CGT疗法定价难以实现可及性,原本药企还可通过CDMO将生产的高成本分摊,但如今连CDMO代工都没有办法规模化降低成本,这等于是给所有想要入局CGT疗法的企业敲响了警钟。
封面图片来源:每日经济新闻 刘国梅 摄

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
