◎目前,基石药业已有4款创新药的10项上市申请获批。舒格利单抗则为潜在同类最优的肿瘤免疫治疗药物,于2021年底在国内获批上市,目前还未有具体的销售成绩露出。2月23日,基石药业公告,舒格利单抗联合化疗一线治疗转移性非小细胞肺癌的上市许可申请获欧洲药品管理局受理。
◎NMPA官网公示,阿斯利康和第一三共联合开发的注射用德曲妥珠单抗在中国获批上市。在国内HER2 ADC药物研发竞争格局中,第一三共的德曲妥珠单抗占了7个席位,除了本次获批上市的“HER2阳性、转移性乳腺癌”,还包括不可切除或转移性HER2阳性成人乳腺癌、高危HER2阳性早期乳腺癌等。
每经记者|林姿辰 每经编辑|魏官红
《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
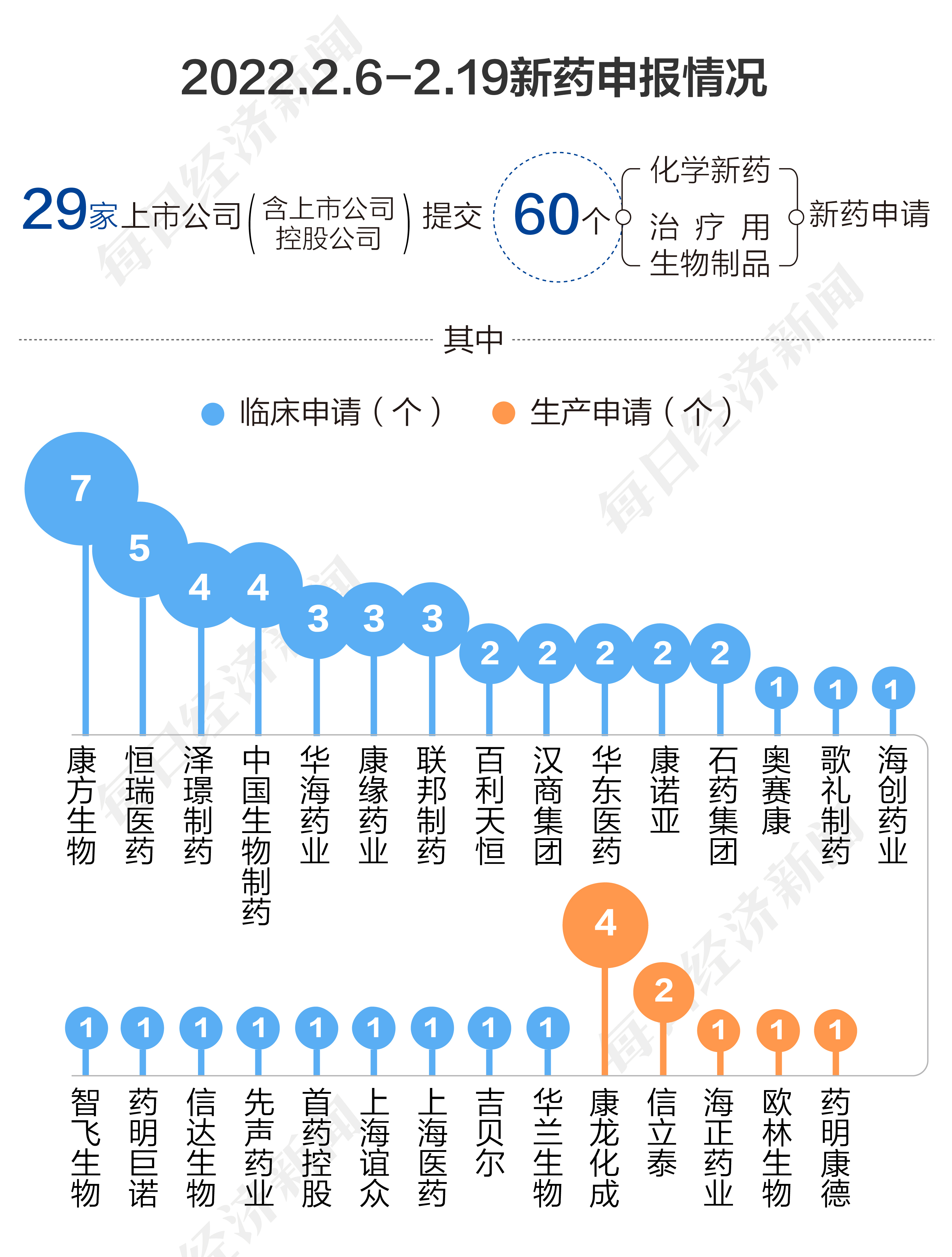
根据药渡数据,2023年2月6日至2月19日,国家药品监督管理局药品审评中心(CDE)共收到29家上市公司(含上市公司控股公司)提交的60个化学新药、治疗用生物制品新药申请。

2023年2月6日至2月19日期间,上市公司方面,康方生物提交7个临床申请;恒瑞医药提交5个临床申请;泽璟制药、中国生物制药各提交4个临床申请;华海药业、康缘药业、联邦制药各提交3个临床申请;百利天恒、汉商集团、华东医药、康诺亚、石药集团各提交2个临床申请;奥赛康、歌礼制药、海创药业、华兰生物、吉贝尔、上海医药、上海谊众、首药控股、先声药业、信达生物、药明巨诺、智飞生物各提交1个临床申请。
另外,康龙化成提交4个生产申请;信立泰提交2个生产申请;海正药业、欧林生物、药明康德各提交1个生产申请。
1、基石药业PD-L1冲刺欧洲市场
2月23日,基石药业发布公告,宣布舒格利单抗联合化疗一线治疗转移性非小细胞肺癌(NSCLC)的上市许可申请(MAA)获欧洲药品管理局(EMA)受理。这是舒格利单抗在大中华区以外的第二项MAA。
舒格利单抗是由基石药业开发的抗PD-L1单克隆抗体,于2021年获得中国国家药品监督管理局(NMPA)批准上市,联合化疗用于转移性鳞状和非鳞状NSCLC患者一线治疗,并于2022年获批用于治疗同步或序贯放化疗后未出现疾病进展的、不可切除、III期NSCLC患者。
作为全球首个同时覆盖III期和IV期NSCLC适应症的PD-(L)1抗体,舒格利单抗已通过创新许可与准入途径(ILAP)在英国获得了包括MHRA在内的ILAP合作组织授予的创新凭证认定。ILAP于2021年初推出,旨在加速英国药物的开发和上市。
行业洞察:
对于国内创新药企业来说,市场份额大、支付能力强、产品定价高的美国市场常常是出海首选,但在肺癌这一最大的肿瘤免疫治疗适应症领域,国产药物赴美上市的好消息并不多。
2022年初,信达生物与礼来合作的PD-1单抗向美国食品药品管理局(FDA)递交上市申请,适用症为联合培美曲塞和铂类用于非鳞状非小细胞肺癌一线治疗。因为该申请主要基于在中国开展的临床三期资料,最终以被FDA要求补充额外临床试验,折戟而归告终。
欧洲市场是全球仅次于美国的肿瘤药物市场。数据显示,到2025年,全球肿瘤药物市场规模将达2690亿美元,预计以PD-(L)1抗体为主的肿瘤免疫治疗药物销售约占20%。根据知名机构Evaluate Pharma的预测,到2025年,PD-(L)1抗体的欧洲总销售额将达到157亿美元,接近美国市场规模。
其中,肺癌是欧洲第三大确诊癌症(2020年),也是导致癌症相关死亡的主要原因,占癌症死亡人数的五分之一。在欧洲,约50%至70%的肺癌患者确诊时已发展为IV期阶段。肺癌预后较差,患者的5年生存率仅为13%。全球范围内,NSCLC约占所有肺癌的85%。
公司点评:
2月初,基石药业发布正面盈利预告,预计2022年总收入不少于4.75亿元,不包括以股份为基础的付款开支的年度亏损预计将不超过8亿元,同比2021年增收减亏,主要原因是产品密集上市。
目前,基石药业已有4款创新药的10项上市申请获批,其中三款药物为同类首创精准治疗药物;舒格利单抗则为潜在同类最优的肿瘤免疫治疗药物,于2021年底在国内获批上市,目前还未有具体的销售成绩露出。
PD-(L)1抗体登陆欧洲市场的潜在收益是明确的——2020年10月,基石药业独家授权EQRx在大中华区以外地区开发和商业化舒格利单抗(PD-L1)及CS1003(PD-1),并约定了1.5亿美元的首付款,和最高可达11.5亿美元的里程碑付款以及额外的分级特许权使用费。
同时,舒格利单抗的适应症拓展还在继续。2月28日,基石药业发布公告,舒格利单抗联合化疗一线治疗不可手术切除的局部晚期或转移性胃/胃食管结合部腺癌的新适应症上市申请获NMPA受理。这也是该药物在国内的第四项适应症。
2、决战乳腺癌:首个ADC新药获批明星药物赫赛汀迎来强劲对手
2月24日,NMPA官网公示,阿斯利康和第一三共联合开发的注射用德曲妥珠单抗在中国获批上市。
这是一款靶向HER2的抗体偶联药物(ADC),已在海外获批多种适应症。本次为该药首次在中国获批,针对的适应症为单药适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
该药物此次获批是基于一项名为DESTINY-Breast03的临床研究结果,这是全球首个且目前唯一在HER2阳性晚期乳腺癌二线治疗中头对头对比ADC药物并取得阳性结果的随机、多中心、开放标签III期临床研究,其中亚洲患者占半数以上。
行业洞察:
罗氏的HER2靶向药物赫赛汀(通用名:曲妥珠单抗)是乳腺癌一线用药领域出场率极高的明星药物。2014年赫赛汀专利陆续开始在欧盟、美国等地到期,赫赛莱(通用名:恩美曲妥珠单抗)作为接棒产品出现,拉开了HER2 ADC药物进军乳腺癌的序幕。
2018年,恒瑞医药旗下有“口服‘赫赛汀’”之称的马来酸吡咯替尼更是在国内获批治疗乳腺癌,成为首个国产HER2靶向药物。复宏汉霖的汉曲优也在2020年拿下国内赫赛汀“首仿”。
但是,靶向HER2的ADC药物却很少,阿斯利康和第一三共联合开发的注射用德曲妥珠单抗,是国内获批该适应症的唯一药物。
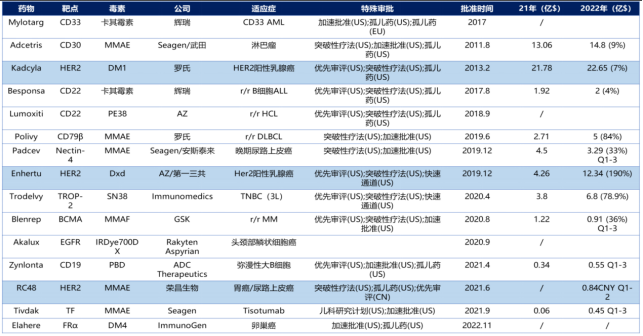
全球已上市ADC药物及销售额
图片来源:东吴证券研报
在国内企业方面,3月2日,浙江医药宣布,旗下新码生物的HER2 ADC药物ARX788用于治疗HER2阳性局部晚期或转移性乳腺癌的随机、开放、对照、II/III期多中心临床研究期中分析已达到预设的有效性标准,可以停止研究。
如若顺利,这将成为第一款申报上市用于乳腺癌的国产HER2 ADC,超越当前同适应症处于Ⅲ期阶段的荣昌生物、恒瑞医药、复星医药和东曜药业。
公司点评:
在国内HER2 ADC药物研发竞争格局中,第一三共的德曲妥珠单抗占了7个席位,除了本次获批上市的“HER2阳性、转移性乳腺癌”,还包括不可切除或转移性HER2阳性成人乳腺癌、高危HER2阳性早期乳腺癌、HER2阳性不可切除的、局部晚期或转移性非小细胞肺癌等。
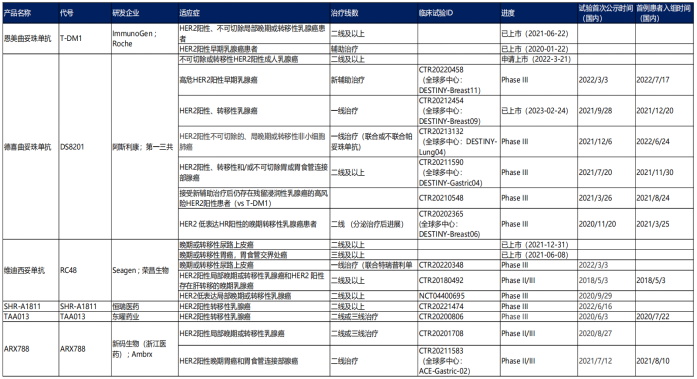
国内HER2 ADC药物研发竞争格局(临床III期及以上品种)
图片来源:东吴证券研报
而这只是第一三共3款核心药物之一。公司的另两款核心药物分别为datopotamab deruxtecan和patritumab deruxtecan,前者靶向TROP2,在研适应症包括单独或与PD-1抑制剂度伐利尤单抗联用治疗三阴性乳腺癌患者;后者靶向HER3,其在中国启动的Ⅲ期临床试验针对携带EGFR激活突变的转移性或局部晚期非鳞状NSCLC。
另外,第一三共还有4款ADC药物正处于临床开发阶段,用于治疗乳腺癌、胃癌、肺癌和结直肠癌等多个癌种。
其中,德曲妥珠单抗是第一三共的明星药物。公司年报显示,2022年,该产品在全球的销售额为1616亿日元,约合12.38亿美元,同比增长205%。在临床需求巨大的中国市场,这款被中国工程院院士徐兵河称赞“改变了(中国)近10年乳腺癌治疗格局”的药物,无疑迎来了更多机会,也为第一三共的ADC药物进入中国市场开了个好头。
不过,国内的支付体系也对第一三共提出了新的挑战。今年,德曲妥珠单抗是否参与、能否通过2023年的国谈,将成为市场关注的焦点。
封面图片来源:视觉中国-VCG11385119793

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
