◎对于神州细胞而言,即使SCTV01E和SCTV01C顺利获批上市,其未来的市场销售仍面临较为激烈的竞争态势,并同时受全球疫情发展变化、新冠疫苗接种率、公司生产能力等多种因素影响,后续商业化前景仍存在不确定性。
◎云顶新耀方面对《掘金创新药》研究员表示,在云顶新耀创立之初,授权引进模式帮助公司快速扩增了极具潜力的研发管线,搭建了有规模、高质量的公司。但随着公司不断发展,团队也正在逐步加强自主研发能力。
每经记者|林姿辰 每经编辑|魏官红
《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
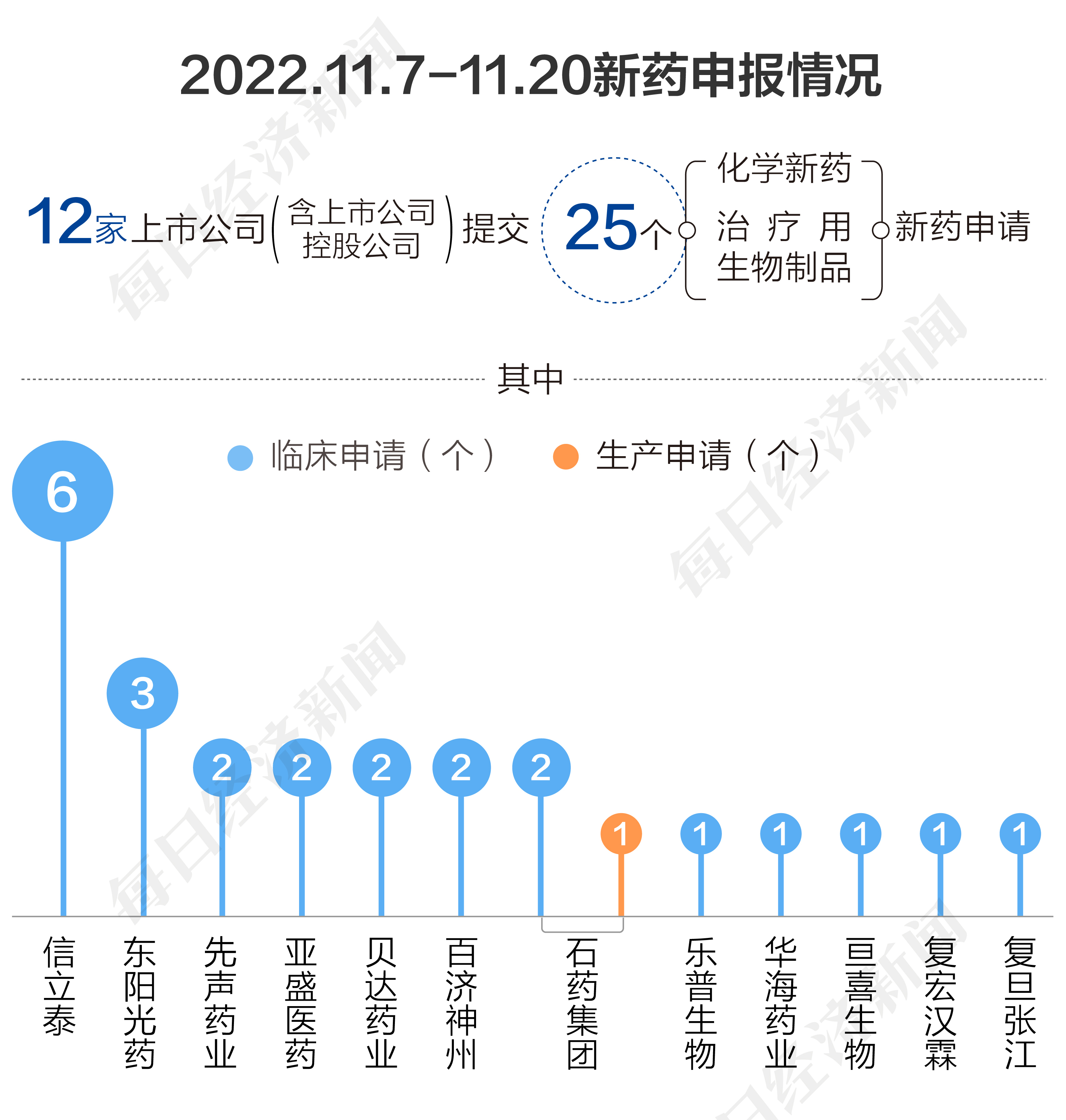
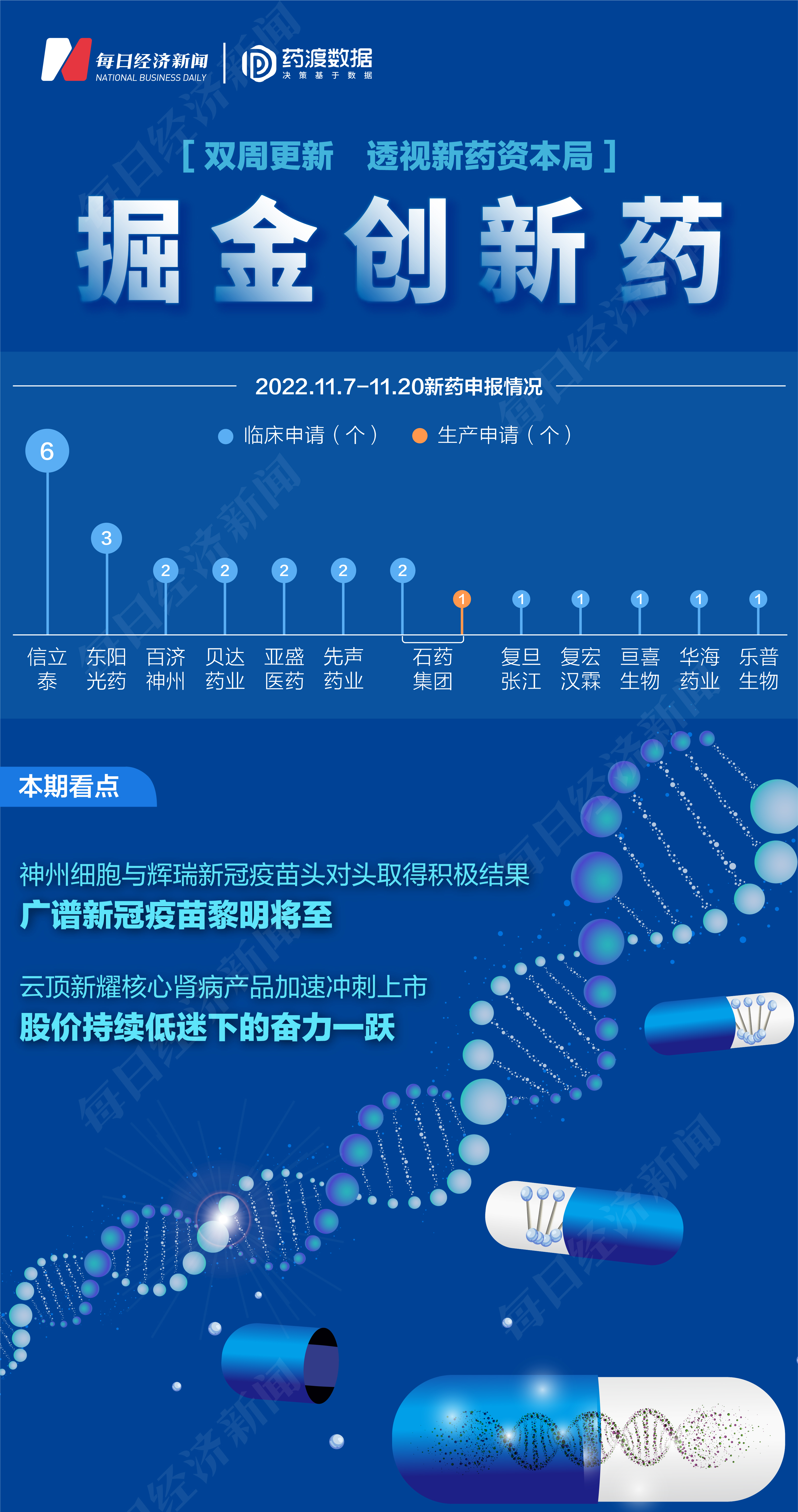
根据药渡数据,2022年11月7日至2022年11月20日,国家药品监督管理局药品审评中心(CDE)共收到12家上市公司(含上市公司控股公司)提交的25个化学新药、治疗用生物制品新药申请(同一公司同一药物不同规格的申报,不分开计算)。

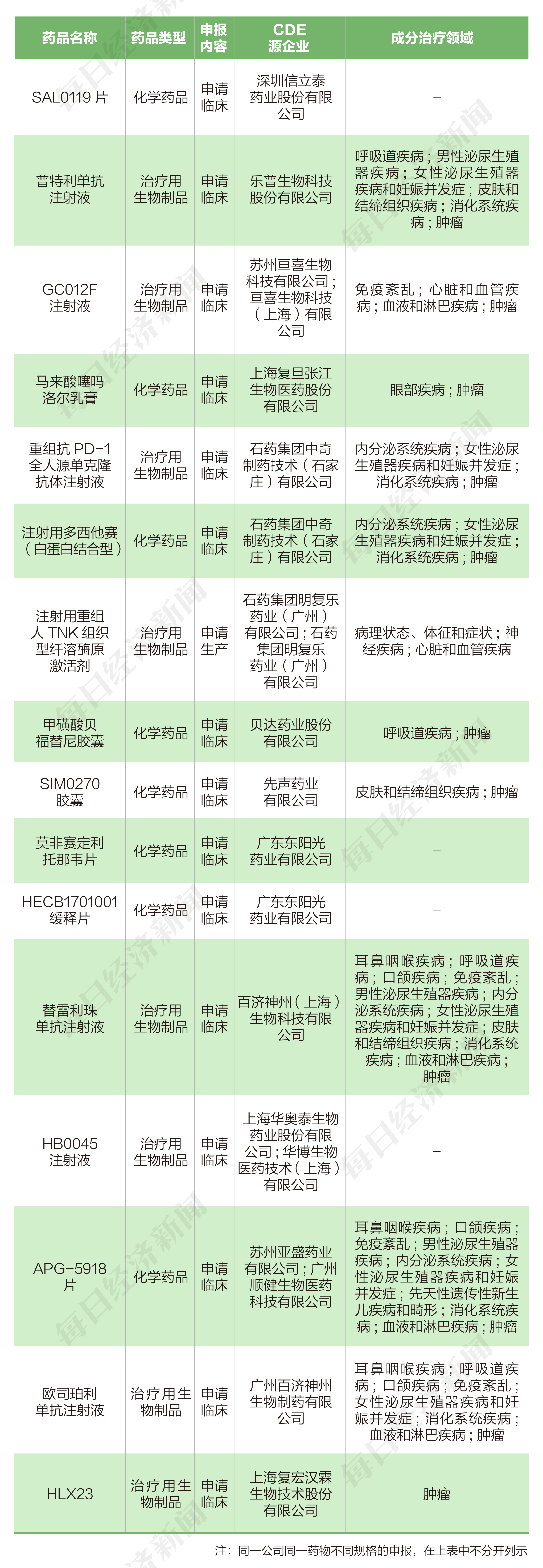
2022年11月7日至11月20日期间,上市公司方面,信立泰提交6个临床申请;东阳光药提交3个临床申请;百济神州、贝达药业、亚盛医药、先声药业各提交2个临床申请;复旦张江、复宏汉霖、亘喜生物、华海药业、乐普生物各提交1个临床申请;石药集团提交2个临床申请和1个生产申请。
1、神州细胞与辉瑞新冠疫苗头对头试验取得积极结果 广谱新冠疫苗黎明将至
11月15日晚,神州细胞发布公告称,控股子公司自主研发的2价和4价重组新冠病毒疫苗已进行阿联酋III期安全性和免疫原性临床试验与mRNA疫苗头对头比较的期中分析并取得积极结果。其中头对头疫苗为辉瑞mRNA疫苗,是获得FDA(美国食品药品监督管理局)正式批准的全球首款mRNA新冠疫苗。
神州细胞公告的资料显示,SCTV01C的活性成分分别包含两种WHO认定的主要变异株阿尔法(Alpha)和贝塔(Beta)的重组S三聚体蛋白抗原,并采用比传统铝佐剂更能显著增强Th1细胞的水包油新型佐剂。SCTV01E是在SCTV01C的基础上新增了后续新出现的德尔塔和奥密克戎两个变异株S三聚体蛋白抗原构成的4价改良型疫苗升级版。

SCTV01C和SCTV01E与mRNA苗头对头比较期中分析结果
图片来源:公司公告
行业洞察:
截至目前,已有7家企业的新冠疫苗可在国内销售,其中北生所、武汉所、科兴、康希诺、智飞生物是有条件批准,康泰生物和丽珠集团是紧急使用,但随着新冠疫情形势不断变化,防疫对新冠疫苗提出了新的要求。
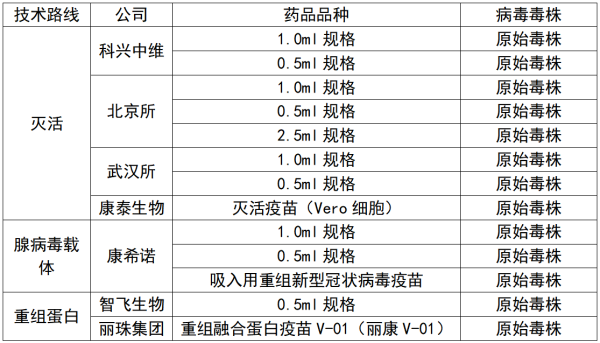
目前国内销售的新冠疫苗 数据来源:浙商证券研报
11月11日,国务院应对新型冠状病毒肺炎疫情联防联控机制综合组发布《关于进一步优化新冠肺炎疫情防控措施 科学精准做好防控工作的通知》,提出加快开展具有广谱保护作用的单价或多价疫苗研发,依法依规推进审批。
这意味着手持mRNA疫苗和重组蛋白疫苗研发项目的企业面临着更多机会。而从药品品种和所处阶段综合评价,神州细胞的SCTVO1C更具优势。
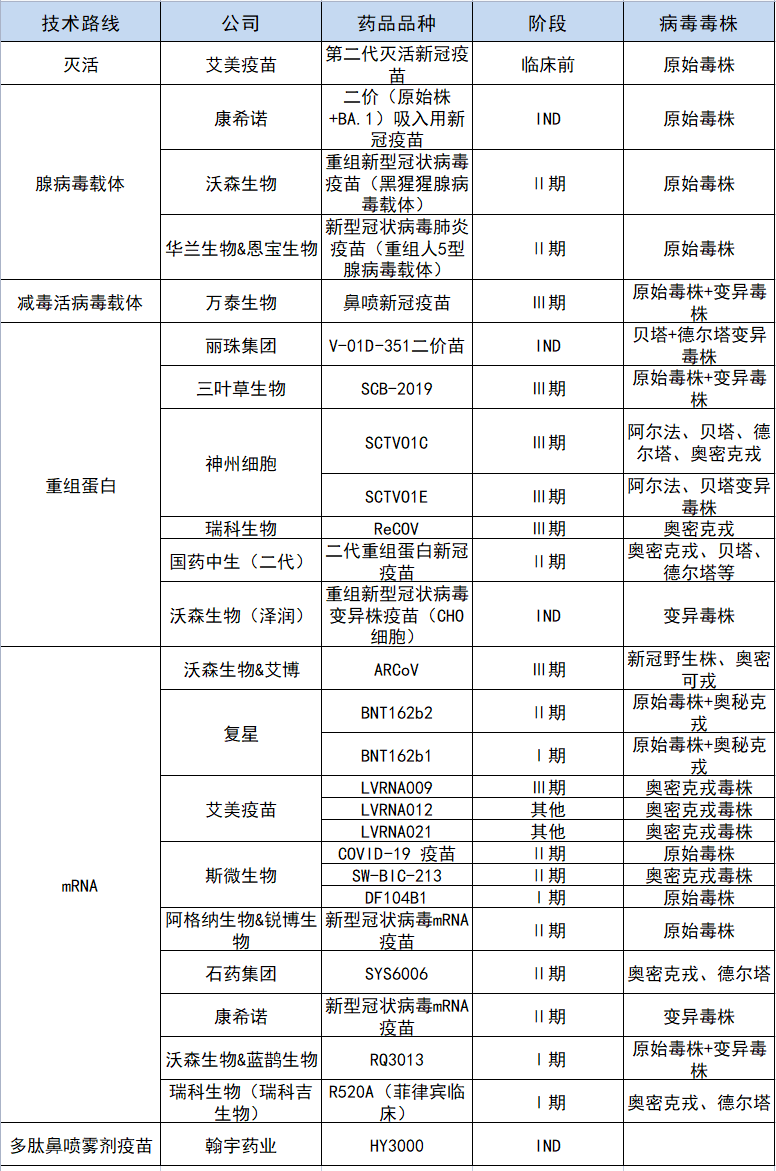
国内在研新冠疫苗 数据来源:浙商证券研报
但新冠疫情的走势仍是最大的不确定因素。根据WHO的统计,截至2022年11月11日,全球在研新冠疫苗已有172个进入临床试验阶段。目前全球已获批附条件上市或紧急使用的新冠疫苗产品已超过50个。即使SCTV01E和SCTV01C顺利获批上市,其未来的市场销售仍面临较为激烈的竞争态势,并同时受全球疫情发展变化、新冠疫苗接种率、公司生产能力等多种因素影响,后续商业化前景仍存在不确定性。
公司点评:
神州细胞目前有2款商业化产品。一款是今年8月获批上市的CD20靶点的瑞帕妥单抗,可用于治疗新诊断CD20阳性弥漫大B细胞性非霍奇金淋巴瘤(DLBCL)成人患者;另一款是2021年7月获批上市的“安佳因”(重组人凝血因子VIII)。这款适用于成人及青少年(≥12岁)血友病A患者的药物,借助医保报销的优势快速放量,是公司2022年前三季度6.50亿元营收的主要来源,其新增儿童适应症的补充上市申请已经获得国家药监局受理,并已完成生产和临床的现场核查。
此外,根据2022年半年报,神州细胞有2个生物药品种处在上市申请阶段,6个品种处于临床研究中后期阶段。
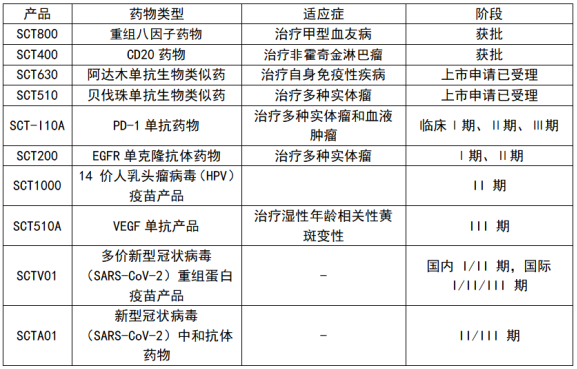
资料来源:神州细胞2022年半年报
需要注意的是,神州细胞仍需直面研发、销售支出与有限收入之间的差距。公司2022年三季报显示,由于研发人员增加以及多个产品正在开展针对不同适应症的II/III期临床研究,神州细胞第三季度的研发投入为2.70亿元,同比增加59.79%;前三季度研发投入为6.62亿元,占营业收入的比例为101.72%。而随着两款产品商业化的推进,神州细胞前三季度的销售费用由2021年同期的6760.48万元上涨至1.66亿元。
截至今年的9月30日,公司负债合计27.21亿元,总资产为21.14亿元,流动资产为10.22亿元。
从融资面看,11月10日,神州细胞完成了向特定对象发行A股股票,发行价格48.33元/股,发行规模4.83亿元。
2、云顶新耀核心肾病产品加速冲刺上市 股价持续低迷下的奋力一跃
11月15日,云顶新耀宣布中国国家药品监督管理局(NMPA)已受理Nefecon(美国商品名:TARPEYO,欧盟商品名:Kinpeygo)的新药上市许可申请,用于治疗具有进展风险的原发性IgA肾病(IgAN)成人患者。2020年12月,NMPA将Nefecon纳入突破性治疗品种。11月28日,云顶新耀宣布称,中国台湾地区和韩国药政部门授予Nefecon加速审批,用于治疗原发性IgA肾病。
资料显示,Nefecon是瑞典公司Calliditas研发的一款布地奈德口服缓释制剂,属于一种糖皮质激素,于2021年12月15日在美国获得FDA加速批准。2019年6月,云顶新耀引进Nefecon并推进其在国内的临床研究。
云顶新耀首席执行官罗永庆对外表示,Nefecon是全球50年来首款针对IgA肾病的治疗药物,而在中国,慢性肾病是严重威胁公众健康的疾病之一,约有500万人受IgA肾病困扰。Nefecon是公司肾病产品组合中的主打候选产品;是云顶新耀商业化的重点产品之一。
行业洞察:
IgA肾病是全球最常见的原发性肾小球肾炎,原发性IgA肾病是其中一种,其进展会伴发肾小球硬化、肾间质纤维化、肾功能不全、蛋白尿和高血压。从患病率看,亚洲人群患病率偏高,中国IgAN的患病率约占原发性肾小球肾炎的54.3%,但国内尚无获批治疗IgA肾病的药物。
据东吴证券梳理,目前IgAN的治疗方式主要包括支持性治疗、免疫抑制剂、生物制剂、手术治疗、中药治疗和其他治疗。其中,支持性治疗为IgAN一线首选方案,但全病程缺乏创新治疗方案。
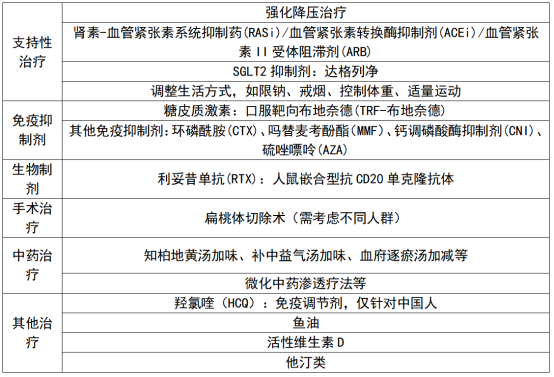
资料来源:东吴证券研报
由于发病机制尚不明确且无特定治疗药物,IgAN药物市场广阔。根据弗若斯特沙利文测算,全球IgAN治疗药物市场预计将从2020年的5.67亿美元增至2025年的11.96亿美元,平均年复合增长率达16.1%,中国市场则是预计从0.37亿美元增至1.09亿美元,平均年复合增长率达24.6%。
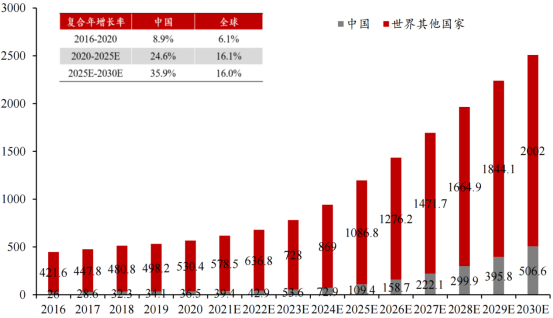
全球及中国IgA肾病药物市场规模逐年增长(百万美元)
图片来源:东亚前海证券研报
目前,国内外多家创新药企将研发重点对准IgAN,主要分为补体抑制剂类药物和针对内皮素受体、APRIL等靶点药物两种,前者是未来治疗高风险IgA患者的重要研发方向,Nefecon属于后者,并于2021年12月15日获得FDA加速批准。
从研发进度看,Nefecon在国内外处于领先位置,而距离其较近的研发项目均为国际知名药企操刀,例如诺华(Novartis)、奥麦罗制药(Omeros)、艾伯维等。此外,康诺亚、荣昌生物、恒瑞医药均有IgAN药物在研。
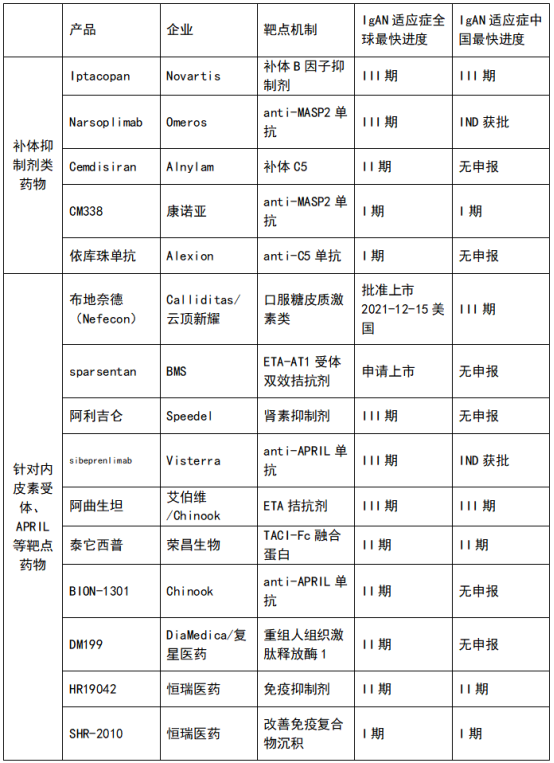
数据来源:东吴证券研报
公司点评:
根据云顶新耀2022年中期报告,公司的产品管线包括治疗药物及mRNA疫苗领域的10款潜在的同类首创或同类最佳临床阶段资产,其中Xerava(依拉环素)在美国、欧盟、英国的NDA(新药上市申请)已批准,Tarpeyo(Nefecon)在美国及欧盟的NDA已批准。再加上PTX COVID19-B这一号称“潜在的同类最优mRNA新冠疫苗”,云顶新耀的三款核心产品看起来前景无限,但公司股价一路下跌,11月28日收盘价为9.99港元/股,不足历史最高价的十分之一。
原因之一是公司唯一且首款上市的药品拓达维(英文商品名:Trodelvy,中国药品通用名:戈沙妥珠单抗)的缺席。
今年8月,云顶新耀将包括大中华区在内的多地开发和商业化“拓达维”的独家权利转让给了曾经的卖方Immunomedics。粗略估计,云顶新耀或从拓达维的买卖中赚3.3亿美元,但换个角度,这也是行业资本收紧背景下,药企回流现金的缩影。云顶新耀在中报中称,“精简资源并专注于更有针对性的治疗领域,并通过收购及内部发现为未来增长作准备”,“本公司正在就收购不同治疗领域的同类首创或同类最佳资产进行多项积极讨论”。
作为成立于2017年的生物制药公司,云顶新耀目前覆盖肿瘤、免疫学、心脏疾病及感染性疾病的多条管线大多通过License-in(授权引进)方式建立,其中包括今年1月,公司从新加坡实验药物研发中心引进的一组3CL蛋白酶抑制剂的全球独家授权药物EDDC-2214,用于治疗新冠病毒肺炎。不过,这些授权引进的项目并未在资本市场激起太大水花。
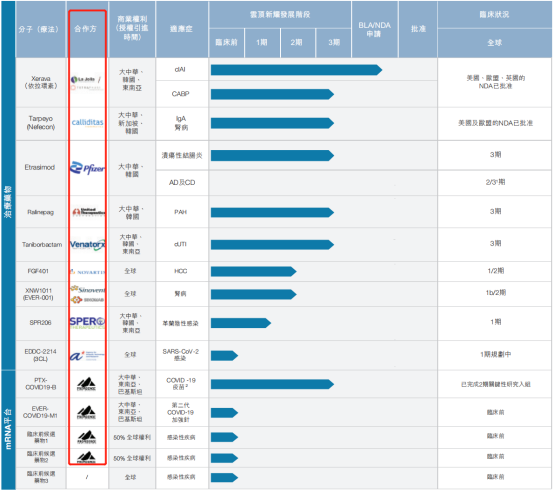
云顶新耀的产品管线多为通过License-in方式引入
图片来源:公司2022年中期报告
12月2日,云顶新耀方面对《掘金创新药》研究员表示,在云顶新耀创立之初,授权引进模式帮助公司快速扩增了极具潜力的研发管线,搭建了有规模、高质量的公司。但随着公司不断发展,团队也正在逐步加强自主研发能力。
今年2月,公司的首个新药研发中心落地上海。公司内部研发团队正开展针对肾病和mRNA技术平台等领域的创新药物和疫苗研发。在肾病领域,现有多个研发项目正处于临床前阶段,其中进展最快的一款针对肾小球肾病的候选药物预计将在未来两年内提交临床试验申请。公司已完成mRNA平台的临床规模技术转移,计划于近期在中国和其他云顶新耀授权区域针对奥密克戎(Omicron)的2价加强针候选疫苗EVER-COVID19-M1.2提交临床试验申请;其他非新冠疫苗也有望于2023年进入临床试验(IND)申请。
此外,云顶新耀表示,公司股价自10月底以来已上涨了近一倍,但目前仍存在严重低估。未来,在多重利好消息的刺激下,公司股价有望再上一个台阶。
封面图片来源:摄图网-401491749

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
