每经记者|林姿辰 每经编辑|陈俊杰

■ 相关公司:荣昌生物(SH688331,股价54.08元,市值294.3亿元)
■ 核心竞争力:中国首个自主研发ADC药物;全球首创双靶点治疗系统性红斑狼疮生物新药;抗体和融合蛋白、ADC、双抗三大技术平台
■ 所属概念:生物科技
都说出名要趁早,荣昌生物(SH688331,股价54.08元,市值294.3亿元)偏偏“晚熟”。2021年,荣昌生物靠两款重磅创新药震动行业,在此前的十多年里,公司一直进账为零。
大多数行业难以理解创新药领域的煎熬,有产品上市就意味着有资金补血,这对创新药企业尤为重要。半年报显示,公司上半年实现营业收入3.50亿元,同比增长1033.35%,这增速在461家科创板企业中排名第二,仅次于安旭生物(SH688075,股价83.8元,市值76.07亿元)。
早在十几年前,海归博士房健民与荣昌制药团队决定合作创业的时候,就做好了“十年磨一药”的准备。但他们没有预料,今天的中国创新药产业已经发生深度变革。
如今回望,荣昌生物没做抗癌“神药”PD-1,没做仿制药,的确错过了一些赚钱“风口”,但在肿瘤药物研发重归创新、资本回归理性的2021年,荣昌生物却凭实力脱颖而出了。
8月18日,荣昌生物联合创始人兼首席执行官房健民接受《每日经济新闻》记者专访。他表示,差异化仍是创新药研发的关键。而国际化既是检验药物价值的试金石,也是中国创新药企的终极目标:“只有国际化做成功了,一家中国企业才算真正的成功”。

明星项目曾难遇伯乐
10余年坚守终获成功

今年3月,14岁的荣昌生物在科创板挂牌上市,正式打开“A+H”双融资渠道。此时,距离公司第一款新药上市刚刚过去一年。
2021年3月,荣昌生物泰它西普(商品名:泰爱,研发代号:RC18)获附条件批准上市,成为全球首款双靶点治疗系统性红斑狼疮的生物新药;同年6月,公司抗体偶联(ADC)药物维迪西妥单抗(商品名:爱地希)获附条件批准上市,这款国内首个自研ADC药物于两个月后获得了一笔潜在获益26亿美元的授权大单,极大震动了国内药圈。

图片来源:荣昌制药供图
在采访中,房健民回忆起刚加入荣昌生物时的经历,更像是中国创新药的拓荒史。2008年,在国外生活近20年的房健民决定回国创业。这位专注于创新药研发的海归博士很快发现,国内的企业家对自己手中的项目兴趣不大。他们有的看不懂,有的听到一款新药研发需要“10年10亿美元”后觉得风险太大,不敢投资,直到王威东出现——彼时,荣昌制药董事长王威东致力于推动公司转型,与房健民一拍即合。很快,荣昌制药与房健民共同成立了荣昌生物。
站在历史的坐标系中,业内公认中国创新药产业的发展源于政策改革,兴于资本兴旺。但在更早的2008年时很多条件并不成熟。房健民印象很深刻,最初建团队时,国内创新药产业的CRO(医药研发外包)服务体系、监管体系尚未健全,创新制药领域人才极其紧缺,研发的软硬条件也很差。
不过,作为RC18的设计者,房健民对于这款药物的设计优势很有信心。再加上有荣昌制药公司的资金支持,房健民团队在当时业内难以寻觅的平和心态下,开始了这款新药的研发攻坚。
“有多少钱做多少事。”房健民记得,当时国内没有其他公司做类似的项目,公司走快点走慢点不是特别关键,反而更能以纯粹的心情投入研发。

目标就是做创新药
差异化是第一要义

2013年,泰它西普获得Ⅱ、Ⅲ期临床试验批件,再往后几年,研发费用开始指数级增长,房健民开始感受到资金的压力。
幸运的是,在“44号文”(即《国务院关于改革药品医疗器械审评审批制度的意见》)发布后,中国创新药产业大船缓缓起航。“向投资机构融钱”这一选项从无到有,让荣昌生物品味到了行业春天的味道。2018年,港股“18A”助力无收入、未盈利的生物科技公司上市,让荣昌生物看到了更大的舞台。最终,公司于2020年11月登陆港交所。
“如果没有后面的这些资金,实际上这些年我们也很难做那么多事情。”房健民感慨,做一款新药真正花钱的是进入临床试验后,研发费用呈现指数级增长,“要刹车也刹不住了”。
但是,无论依靠谁,房健民“猎药”时始终坚持“严谨”的态度,把钱花在真正创新的地方。即便这会让公司失掉一些创收的机会,比如错过生物类似药,没走“国外买药,国内上市”的license-in模式,房健民也没有后悔。
他表示,荣昌生物最开始的目标就是做创新药物,做同类第一或同类最佳的药物。“如果我们看到一些药物的缺点,通过创新可以做得更好,那为什么不做呢?我们一定要做创新药。”
泰它西普和维迪西妥单抗的上市恰是房健民“严谨创新”的典例。

图片来源:荣昌制药供图
值得一提的是,在胃癌这个适应症,荣昌生物的维迪西妥单抗凭借差异化取得了成功。记者注意到,维迪西妥单抗重新定义了HER2靶向治疗,开拓性地将HER2低表达肿瘤患者纳入组内,在无药可用的三线胃癌病人中获得了较好疗效,并在尿路上皮癌获得较好疗效,被FDA授予“突破性疗法”认定。
房健民认为,一款好的新药“好的设计就等于成功了一半”,研究者应该研究前人走过的道路,找到存在的问题,找到更高一筹的解决办法。
“现在我们选择靶标或适应症也比较谨慎,首先从科学、机制、重要性上要有一定把握。毕竟,新药研发失败的可能性是很大的。”房健民说。

各国标准差异大
国际化“进两步退一步”

去年8月,维迪西妥单抗上市两个月后,被国际ADC龙头Seagen开出高达26亿美元的潜在付款价(首付款和里程碑付款),一度刷新国内药企单品种海外授权的最高纪录,被视作荣昌生物国际化历程中的重要里程碑。
但回看维迪西妥单抗的出海,却也是被药物疗效推着“第一次吃螃蟹”。
2018年,随着临床试验数据显示该药在治疗胃癌、尿路上皮癌、乳腺癌等方面取得重大突破,荣昌生物在与CDE(国家药品监督管理局药品审评中心)沟通中明确了药物的国际化潜质,决定到美国做关键性临床试验。
由于“开始没想到国际化,很多东西前面没想到”,公司一度也曾走弯路。2019年,房健民带领团队开始寻觅国际合作对象,懂ADC、实力雄厚的Seagen立刻成为最佳选择。
最终,历经长达2年的交流,维迪西妥单抗的优异临床试验结果打动了Seagen,特别是尿路上皮癌(2020年9月)被FDA授予突破性疗法认定,双方赶在2021年春节前进入了实质性合同谈判阶段。
对房健民来说,这次“进两步退一步,翻来覆去地一步一步地往前走”的国际化经历,也让他对国际化有了更多的思考。
首先,药物的战略定位是国际合作中对方最感兴趣的地方,只有药物疗效够硬、市场够大,才能叩开合作的大门。
其次,和国外药监部门的充分沟通是药企国际化的重要工作,如果能通过美国药监局严格的审查,甚至获得突破性疗法认定,就相当于拿到了国际合作的强力背书。
目前,荣昌生物除了维迪西妥单抗,泰他西普在美国启动的针对系统性红斑狼疮的国际多中心III期临床研究,针对IgA肾病适应症的II期临床试验正在稳步推进。
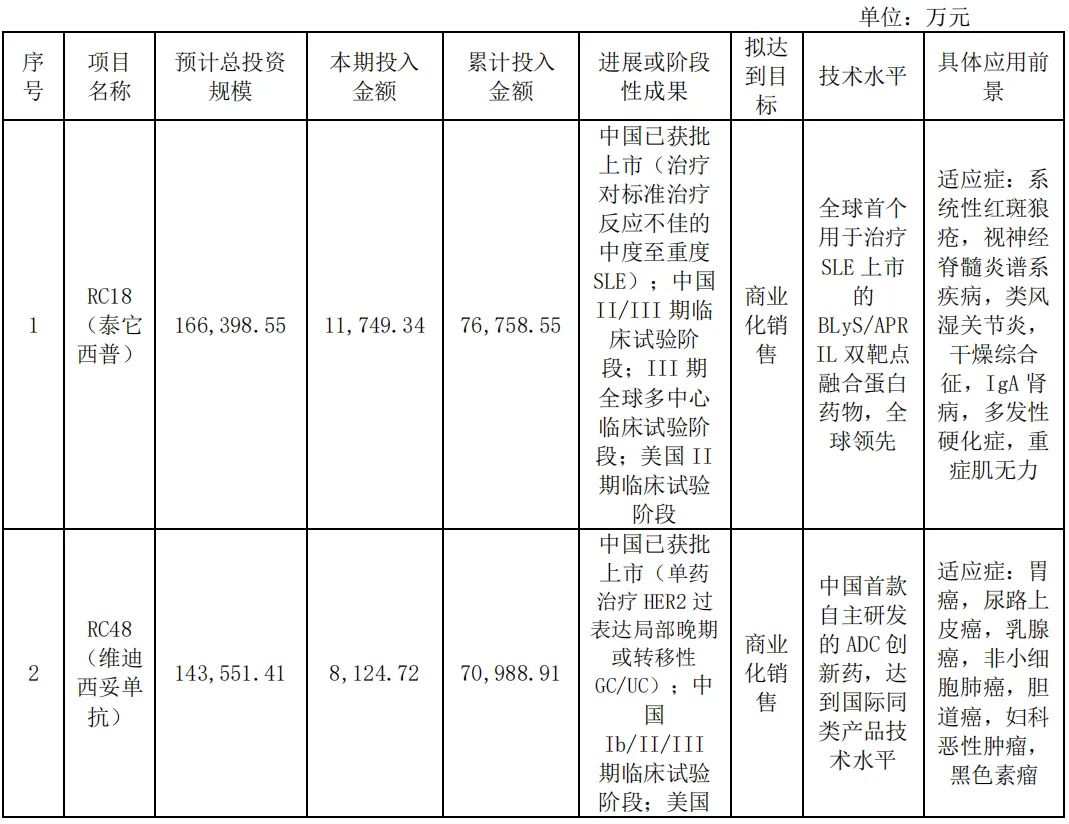
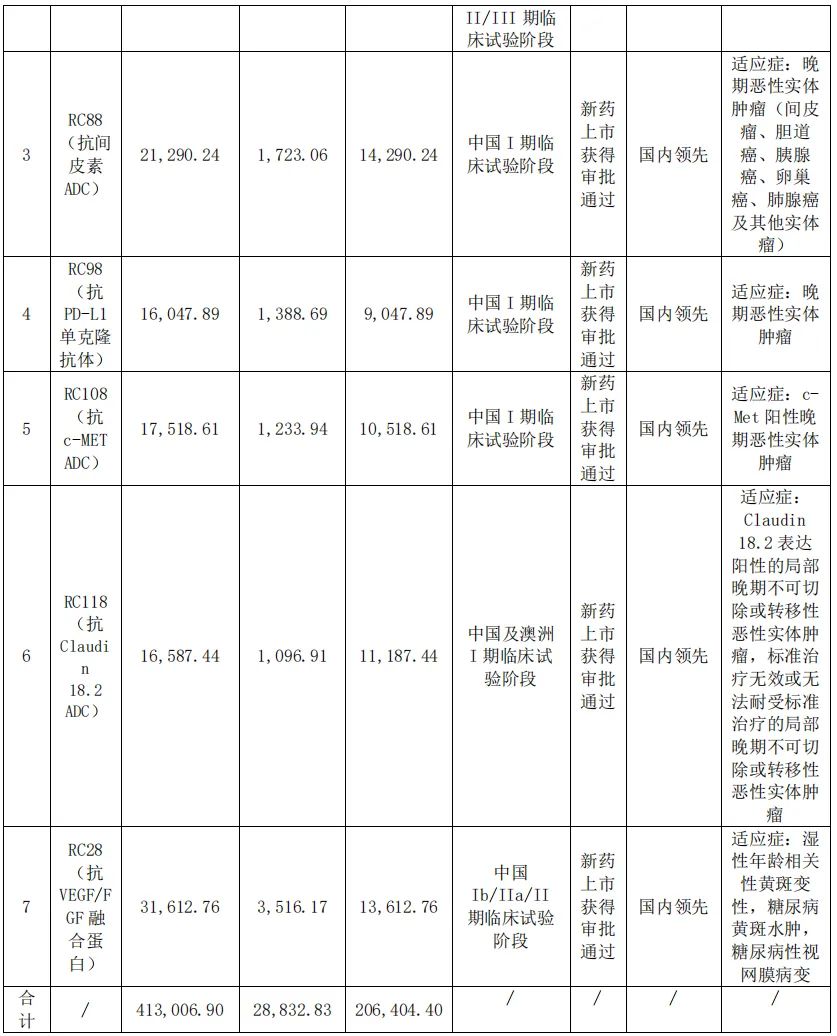
荣昌生物在研项目情况 图片来源:公司半年报
而随着两款产品均被纳入医保目录,荣昌生物在国内的商业化也在提速。
今年上半年,荣昌生物销售费用为1.50亿元,同比增长146.27%,自身免疫和肿瘤科商业化团队计划于下半年继续扩大两支队伍。

“内卷”早有预兆
国际化考验将越来越大

2013年,距离《生物类似药研发与评价技术指导原则(试行)》还有两年的时间,国内药企通过布局PD-1单抗等低门槛抗体药物,用尽可能低的研发风险博取资本的信心。几年后,不少公司都赚取了成立后的第一桶金。
同年,房健民在科技部评选项目中看到30多个PD-1单抗申请项目时,就暗自感叹未来这将是一个拥挤的赛道。彼时,荣昌生物没有加入第一波PD-1单抗研发军,而是集中力量攻克ADC技术,开发ADC药物RC48, 这貌似错过了PD-1那个疯狂的时代,却在PD-1靶点药物研发内卷、政策呼吁创新回归的2021年脱颖而出。
“时代已经变了。”房健民看见,随着新冠疫情等公共卫生事件的发生,大家真正认识到创新药的重要性。此前布局大量生物类似药的公司正陷入被动局面,头部企业则将商业化的船头对准海外。
这是因为,在国内创新药支付体系改革果实成熟前,企业都希望登陆定价机制完善的海外市场,获取更大的商业回报以确保研发的可持续。另一方面,国际化是检验公司和药物价值的试金石,“对于新药创新创业来说,只有国际化做成功了,公司才算真正成功”。
反过来,一旦头部创新药企出海受挫,往往给行业带来难以平复的冲击。
据平安证券8月研报统计,2022年FDA已完成审批的3款中国药物中仅1款成功获批,导致市场对于创新药出海的情绪过于悲观。
但从融资面看,受宏观经济等因素影响,2022年第一季度的全球创新药投融资创下近年新低,同比下滑幅度较大。投资热退潮正席卷全球创新药产业。
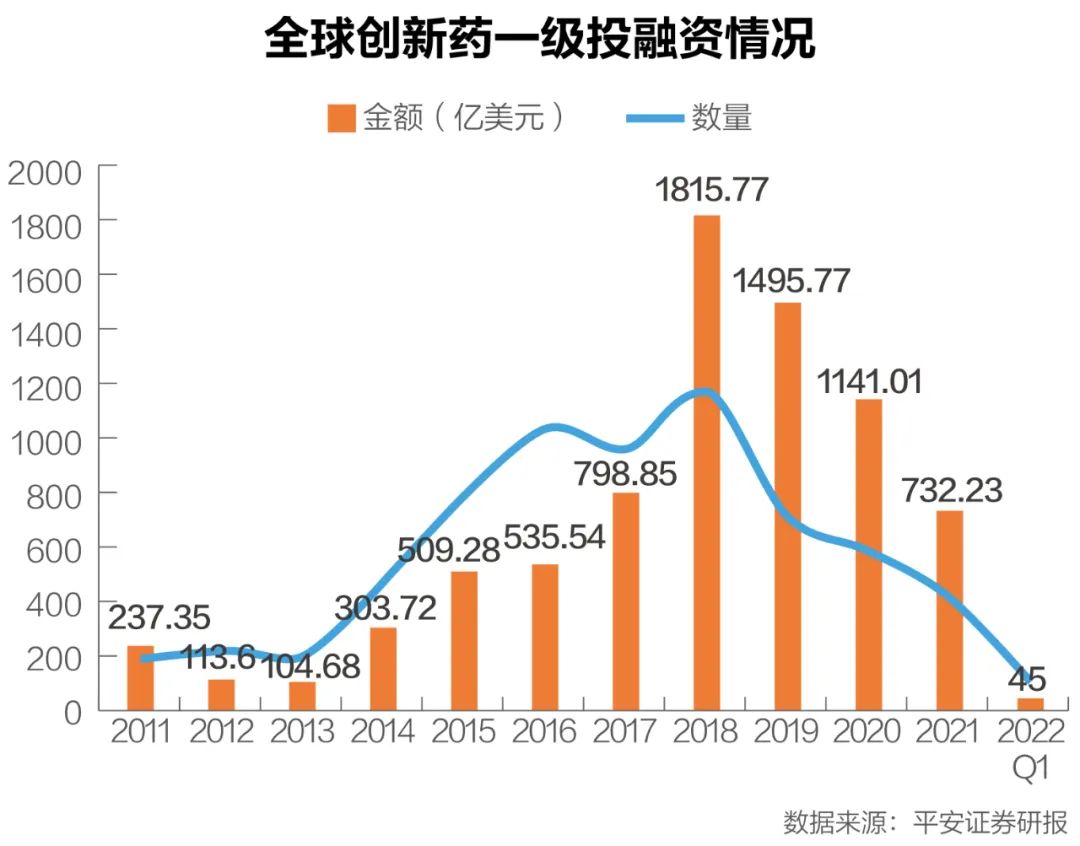
全球创新药一级投融资情况 数据来源:平安证券研报
对此,房健民预计国内企业短期内对于出海的态度会更加谨慎,但更会反思前期行业出海失败的案例。实际上,FDA审查的基本逻辑没有太大的变化,在靶标和适应症上真正具有差异化优势的药物依然可以走出去,“大浪淘沙”的结局是中国创新药企业发展的分化。
成为“Big pharma”(大型生物制药公司)是所有生物技术公司的梦想,但从现实角度,最终被收购兼并的更多。这实际上是个好事情,因为很多(有未满足临床需求的)药物市场不大,企业单独建立销售团队可能是不划算的。
房健民表示,未来5到10年,创新仍是药企的必然选择,但国际化的考验将比以往更大,中国创新药企需要锤炼具有国际竞争力的产品、团队、战略眼光,才能在产业内占有一席之地。
对于荣昌生物,目前已上市的两个产品已经展现出国际化潜力,未来5年可能会在国际市场上“尘埃落地”。

记者 | 林姿辰
编辑 | 陈俊杰
视觉 | 邹利
排版 | 陈俊杰
|本文版权归“每经头条” 所有|
未经许可禁止转载、摘编、复制及镜像等使用
如需转载请向本公众号后台申请



1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
