◎PD-1/PD-L1的红海市场随着斯鲁利单抗的获批进一步加剧,上市的国产PD-1产品目前已上升至7款,与两款进口PD-1产品形成了“2+7”的竞争格局。同时,国内还有四款PD-L1产品获批上市,至此,国内获批的PD-1/PD-L1产品已达到13款。
◎《掘金创新药》研究员认为,斯鲁利单抗的成功获批,将会是复宏汉霖Biopharma之路上浓墨重彩的一步。而在成功获批之后,斯鲁利单抗在治疗MSI-H实体瘤的优异表现将会是支撑其商业价值的基础。
◎《掘金创新药》研究员认为,从上市和申报数据来看,HER2-ADC药物已进入密集收获期。鉴于国内约三分之一的ADC药物靶向HER2,预计该靶点的ADC药物将面临较为激烈的竞争格局,如今Enhertu的申报上市,更是让这一竞争格局进一步激化。
每经记者|许立波 每经编辑|魏官红
《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
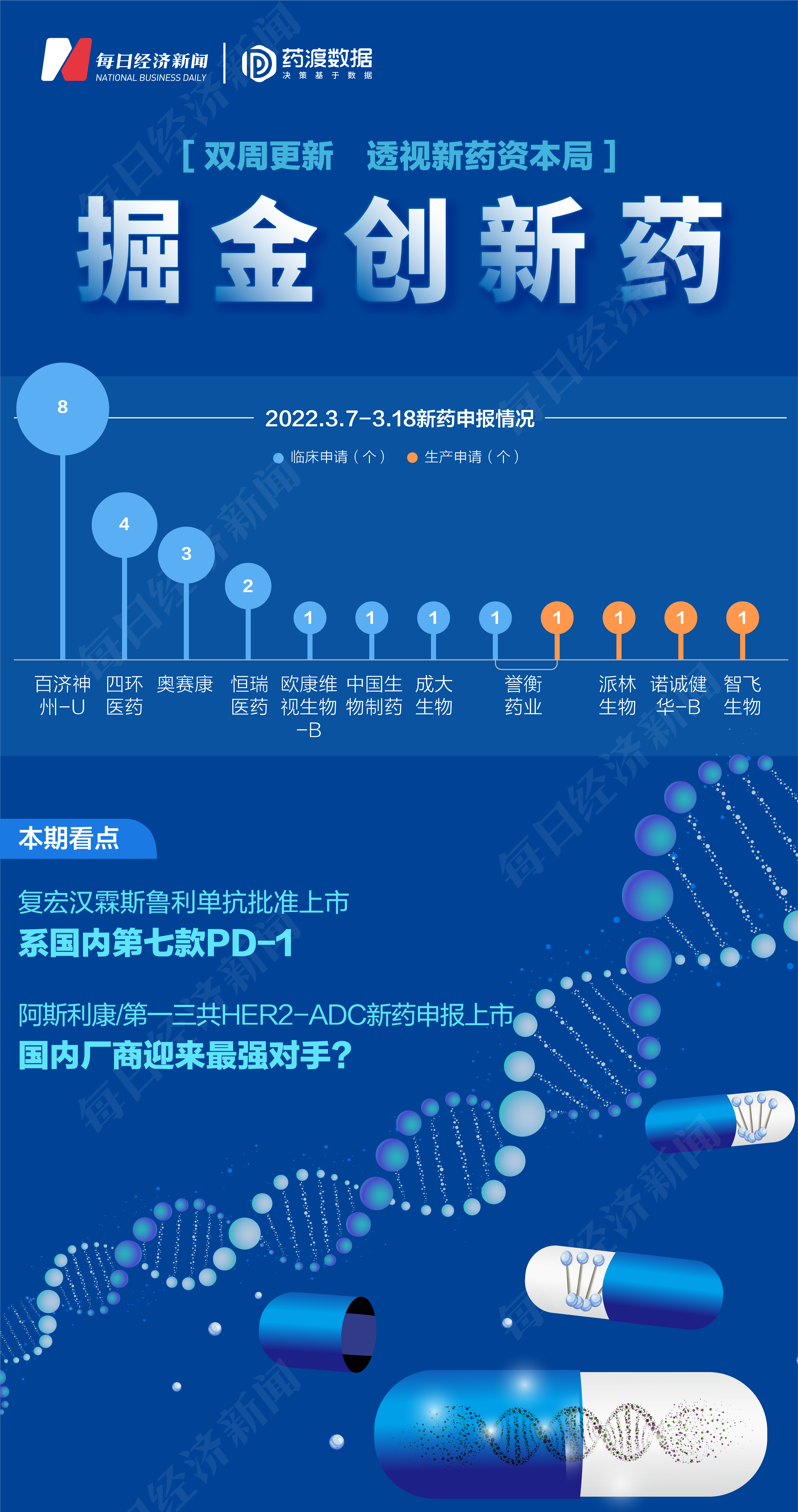
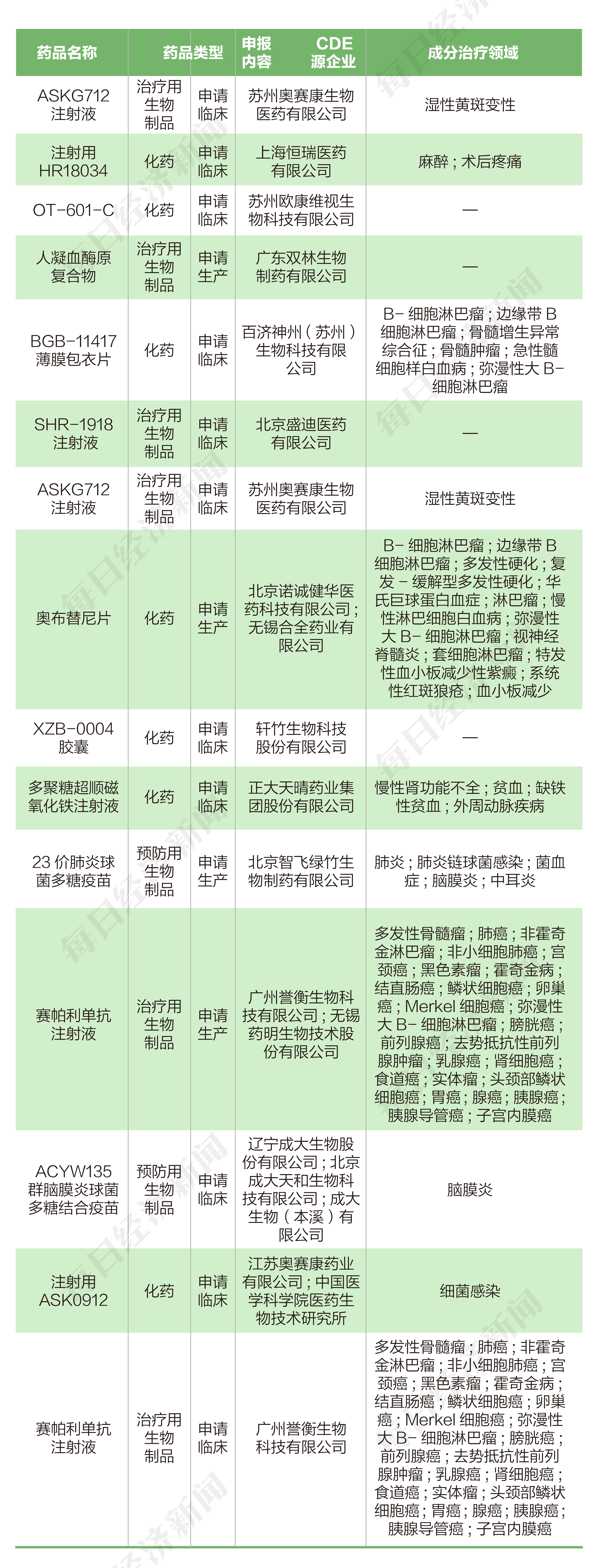
根据药渡数据,2022年3月7日至2022年3月18日,国家药品监督管理局药品审评中心(CDE)共收到11家上市公司提交的25个化学新药、治疗用生物制品新药申请。


2022年3月7日至3月18日期间,百济神州-U(688235.SH)申报8个临床申请,四环医药(00460.HK)申报4个临床申请,奥赛康(002755.SZ)申报3个临床申请,恒瑞医药(600276.SH)申报2个临床申请,欧康维视生物-B(01477.HK)、中国生物制药(01177.HK)、成大生物(688739.SH)各申报1个临床申请。派林生物(000403.SZ)、诺诚健华-B(09969.HK)、智飞生物(300122.SZ)各申报1个生产申请。誉衡药业(002437.SZ)共申报1个临床申请和1个生产申请。
1、复宏汉霖斯鲁利单抗批准上市,系国内第七款PD-1
3月24日,NMPA官网数据显示,复宏汉霖的斯鲁利单抗获批上市,批准适应症应为经标准治疗失败后、不可切除、转移性高度微卫星不稳定型(MSI-H)实体瘤患者。
根据药渡数据,目前美国FDA已批准PD-1靶点药物用于治疗既往一线标准治疗失败的MSI-H/dMMR晚期实体瘤及一、二线MSI-H/dMMR结直肠癌等适应症,此次斯鲁利单抗的获批,应是我国首个针对MSI-H/dMMR晚期实体瘤获批的抗PD-1单抗。
复宏汉霖公告显示,2021年9月,斯鲁利单抗联合化疗一线治疗局部晚期或转移性鳞状非小细胞肺癌的上市申请已经获NMPA受理,治疗既往未接受过治疗的广泛期小细胞肺癌的3期临床试验HLX10-005-SCLC301(NCT04063163)的期中分析结果显示达到了总生存期的主要研究终点,治疗胃癌的中国3期临床正在进行。
此外,斯鲁利单抗联合贝伐珠单抗用于治疗晚期肝细胞癌、转移性非鳞状非小细胞肺癌、转移性结直肠癌的中国临床试验均在进行中,分别处于2期,3期和2/3期;斯鲁利单抗联合HLX07用于复发或转移性头颈部鳞状细胞癌的中国2期临床也在进行中。
行业洞察:
PD-1/PD-L1的红海市场随着斯鲁利单抗的获批进一步加剧,上市的国产PD-1产品目前已上升至7款,与两款进口PD-1产品形成了“2+7”的竞争格局。同时,国内还有四款PD-L1产品获批上市,至此,国内获批的PD-1/PD-L1产品已达到13款。
斯鲁利单抗在疗效层面是否具有优势,姗姗来迟的复宏汉霖又将如何应对激烈的市场竞争,针对这些问题,包括董事长张文杰、首席商务官余诚在内的多位复宏汉霖高管在近日举行的年报业绩交流会上进行了回应。
“如果把肿瘤作为单一市场看待,PD-1产品竞争确实非常激烈。但其实,肿瘤和肿瘤之间,血液瘤和实体瘤之间,从机制、器官、组织学以及治疗方式来看,是不一样的。因此,PD-1产品在不同瘤种上的差异化,不同适应症和不同市场,所处的局面是不尽相同的。”张文杰表示。
公司点评:
3月16日,复宏汉霖公布了2021年度业绩。报告期内,公司共实现营业收入约16.83亿元,同比增长约186%,主要来自多款产品陆续商业化带来的销售收入及授权许可收入等;公司实现归属于母公司的净亏损约9.84亿元,同比缩窄0.96%,主要源于17.64亿元的高额研发投入以及汉曲优等产品上市销售商业化所发生的营销费用。
从这张成绩单看,过去一年,复宏汉霖无疑在商业化上取得了重大突破,这也是支撑其管理层打出“从Biotech走向Biopharma”口号的底气。但问题在于,目前复宏汉霖在业绩上所仰赖的四款商业化产品曲妥珠单抗(汉曲优)、利妥昔单抗(汉利康)、贝伐珠单抗(汉贝泰)、阿达木单抗(汉达远)均为生物类似药,全面纳入集采或已渐行渐近。
尽管张文杰强调,和小分子药物集采相比,生物类似药在集采中的降价幅度会相对温和,对公司影响相对有限,但对于复宏汉霖来说,通过目前的创新药管线来挖掘其他营收点已是必然趋势。在这一背景之下,《掘金创新药》研究员认为,斯鲁利单抗的成功获批,将会是复宏汉霖Biopharma之路上浓墨重彩的一步。而在成功获批之后,斯鲁利单抗在治疗MSI-H实体瘤的优异表现将会是支撑其商业价值的基础。
但不可回避的是,斯鲁利单抗未来商业化上的竞争者已经出现,百济神州的PD-1替雷利珠单抗也在最近先行一步获批了MSI-H适应症。对此,复宏汉霖首席商务官余诚回应称,在MSI-H实体瘤上,中国每年约有30万名新发病人,该产品针对这一适应症仍是蓝海市场,并未过度内卷,甚至可以说是一个相对空白的市场。
“虽然我们PD-1上市的时间比较晚,但我们依然对PD-1有非常强的信心。”余诚表示,而原因来源于几点:第一,斯鲁利单抗在临床数据上具有显著优势,其12个月的总生存期(OS)数据在同类产品当中是最优的;第二,在瘤种的布局上,斯鲁利单抗也具有差异化优势;第三点,复宏汉霖自身商业化团队的能力,可以从汉曲优的销售业绩得以证明。
2、阿斯利康/第一三共HER2-ADC新药申报上市,国内厂商迎来最强对手?
3月21日,CDE官网显示,第一三共/阿斯利康的HER2-ADC药物Enhertu(Trastuzumab Deruxtecan,DS-8201)的上市申请获得NMPA受理。
中信证券研报显示,抗体偶联药物(Antibody-drug conjugates,ADC)由靶向肿瘤特异性抗原或肿瘤相关抗原的单克隆抗体(Antibody)与不同数目的小分子毒素(Payload)通过连接子(Linker)偶联组成。其兼具单抗药物的高靶向性以及细胞毒素在肿瘤组织中高活性的双重优点,可高效杀伤肿瘤细胞,较化疗药物副作用更低,较传统抗体类肿瘤药物具有更好的疗效。且具备与其他疗法联合的协同作用并可用于治疗单抗药物疗效不佳的大量潜在患者,展示出巨大的临床治疗价值。
中信证券称,Enhertu是目前已上市ADC药物中研发管线布局最广的药物,在乳腺癌、胃癌、结肠癌、肺癌等多个领域都展现出非凡的治疗潜力,被称为抗癌“神药”。目前,Enhertu有两个FDA获批的适应症:HER2阳性不可切除或转移性乳腺癌三线及以上;HER2突变的胃或胃食管交界腺癌二线治疗,成为该癌种获批的首个ADC药物。
疗效方面,Enhertu在与罗氏制药的恩美曲妥珠单抗(Kadcyla,T-DM1)针对二线HER2阳性乳腺癌头对头III期临床取得了近乎“碾压”的优势,使用DS-8201的预估12个月PFS达到了75.8%,是T-DM1(34.1%)的两倍还多,ORR数据也展现了同样的优势;安全性方面,两组数据相当。
也正是基于这样优异的临床表现,目前,在美国NCCN乳腺癌指南中,DS-8201已取代T-DM1成为HER2阳性乳腺癌二线疗法的首选方案。
行业洞察:
由于具备良好的靶向性和抗癌活性,抗体偶联药物(ADC)已成为肿瘤领域药物研发的新热点和重要趋势,正受到越来越多的关注。
根据药渡数据,截至2022年1月28日,国内已有2款HER2-ADC药物获批上市,其中包括一款进口药物,即罗氏制药的恩美曲妥珠单抗(Kadcyla,T-DM1);2021年,荣昌生物的HER2-ADC药物——维迪西妥单抗(RC48)获批上市,标志着国产ADC药物的诞生;处于临床三期阶段的有4款,分别为阿斯利康和第一三共的Enhertu、东曜药业的TAA-013、百奥泰的BAT-8001以及浙江医药的ARX-788。此外,还有14款药物处于临床I/II期阶段,其中不乏恒瑞医药、石药集团、科伦药业、三生国健等知名药企。
公司点评:
《掘金创新药》研究员认为,从上市和申报数据来看,HER2-ADC药物已进入密集收获期。而从靶点趋势来看,国内ADC领域布局最多的就是HER2靶点,其次是Trop-2、cMET、EGFR、CD20等。鉴于国内约三分之一的ADC药物靶向HER2,预计该靶点的ADC药物将面临较为激烈的竞争格局,其在研发进展上的内卷程度比起PD-1/PD-L1亦不遑多让,如今Enhertu的申报上市,更是让这一竞争格局进一步激化。
作为目前在HER2-ADC药物中当之无愧的“Best-in-Class”,Enhertu的获批上市或许只是时间问题,面对这一强大对手,国内布局在ADC赛道的创新药企业都将面临巨大压力。
封面图片来源:摄图网-500553887

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
