◎目前国内主要脑膜炎球菌疫苗仍为多糖疫苗(MPSV),但MPSV2和MPSV4无法有效诱导2岁以下儿童的免疫应答,因此结合疫苗(MCV)被认为是未来市场的替代趋势。《掘金创新药》栏目研究员认为,康希诺MCV2和MCV4有望在新生儿市场有较大收获。
◎恒瑞医药的两款药物——脯氨酸恒格列净片、羟乙磺酸达尔西利片获批上市。脯氨酸恒格列净片是首个国产创新SGLT2抑制剂,羟乙磺酸达尔西利片是首个中国原研CDK4/6抑制剂。两款药物的获批意味着恒瑞医药的已上市创新药达到10款。
◎目前“Fast follow”是一条帮助药企较快进行价值变现的途径,但研发me-better(创制新药)和first-in-class(同类第一)药物无疑是未来趋势,对于恒瑞医药来说,其在创新和国际化转型上的动作尤其值得关注。
每经记者|林姿辰 每经编辑|魏官红
《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。

根据药渡数据,2021年最后一周(2021年12月27日至2022年1月2日),国家药品监督管理局药品审评中心(CDE)共收到16家上市公司(含上市公司控股公司)提交的26个化学新药、治疗用生物制品新药申请。
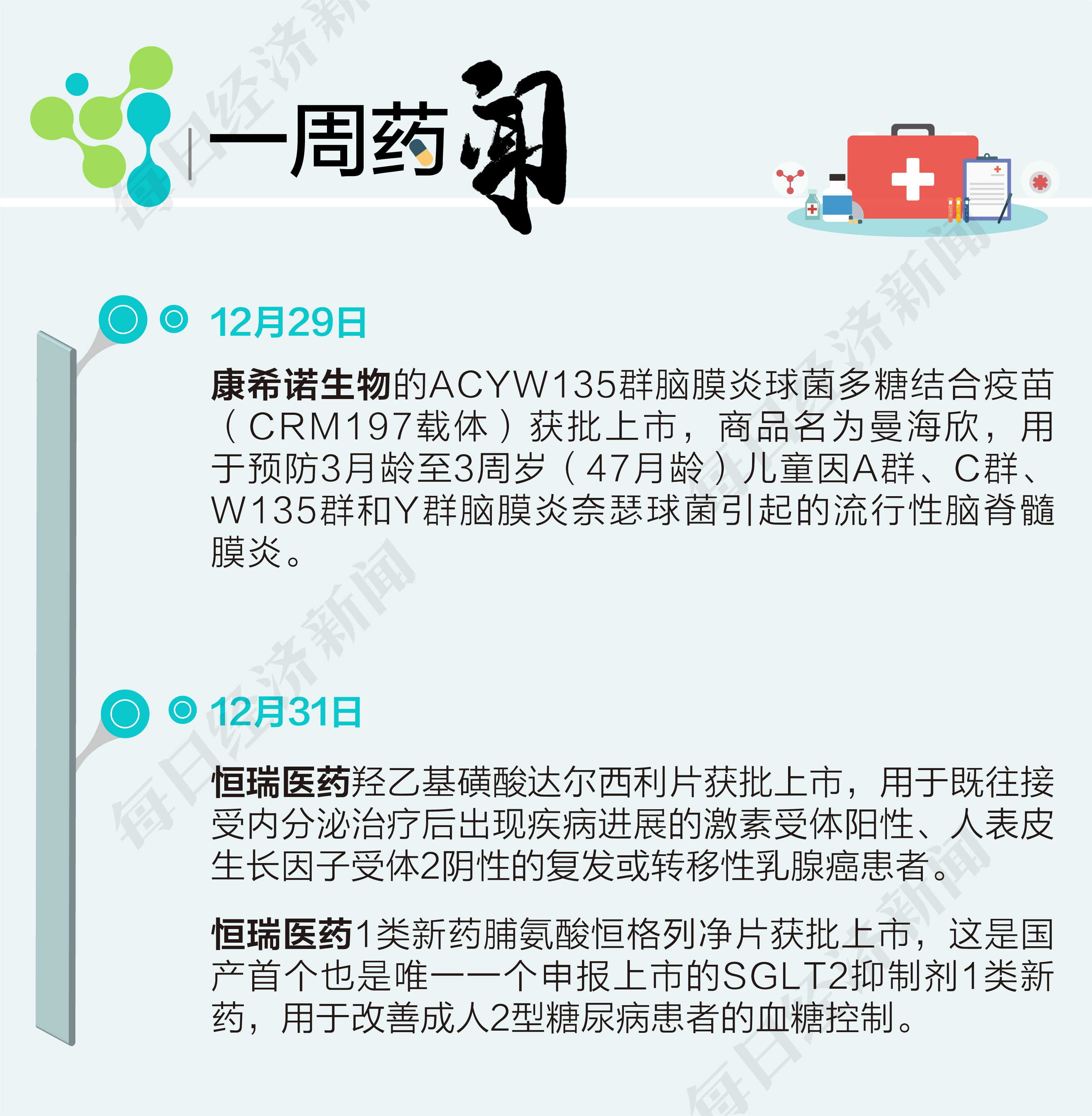
本周上市公司方面,我武生物(300357.SZ)共申报3个生产申请;双鹭药业(002038.SZ)共申报2个生产申请;诺诚健华-B(09969.HK)、翰森制药(03692.HK)、科伦药业(002422.SZ)各申报3个临床申请;信达生物(01801.HK)申报2个临床申请;复星医药(600196.SH)、德琪医药-B(06996.HK)、恒瑞医药(600276.SH)、君实生物-U(688180.SH)、人福医药(600079.SH)、浙江医药(600216.SH)、沃森生物(300142.SZ)、百奥泰-U(688177.SH)、石药集团(01093.HK)、罗欣药业(002793.SZ)各申报1个临床申请。

1.康希诺脑膜炎球菌四价结合疫苗获批 “国内首个”填补高端疫苗空白
2021年12月29日,康希诺-U(688185.SH)公告称,公司已获得国家药监局下发的ACYW135群脑膜炎球菌多糖结合疫苗(CRM197载体)(以下简称MCV4)《药品注册证书》,该疫苗的商品名为曼海欣,用于预防3月龄至3周岁(47月龄)儿童因A群、C群、W135群和Y群脑膜炎奈瑟球菌引起的流行性脑脊髓膜炎。
这是我国首个且唯一覆盖A、C、W135、Y四种血清群的流脑结合疫苗。2020年7月,康希诺生物曾与辉瑞签署推广服务协议,约定在该疫苗获NMPA批准后,由辉瑞公司负责其在中国大陆市场的学术推广。
行业洞察:
脑膜炎球菌病是主要由脑膜炎奈瑟球菌引起的流行性脑脊髓膜炎。其早期症状与流感相似,很难被发现。如果没有及时治疗,可导致患者死亡,死亡率约为20%至35%。罹患脑膜炎还可能导致永久性残疾(如脑部损伤,失聪和认知障碍)等后遗症,其发病率在12个月年龄以下的婴幼儿中最高。
然而,目前国内主要脑膜炎球菌疫苗仍为多糖疫苗(MPSV),但MPSV2和MPSV4无法有效诱导2岁以下儿童的免疫应答,因此结合疫苗(MCV)被认为是未来市场的替代趋势。
此前,全球共有三个流脑4价结合疫苗,分别是巴斯德公司的Menactra(2005年上市),诺华公司的Menveo(2010年上市),葛兰素史克公司的Nimenrix(2012年上市)。
国内上市企业也有布局,走得最快的是康泰生物(300601.SZ)。根据公司2021年半年报,其MCV4已完成三期临床研究现场工作,正处于临床研究总结阶段。智飞生物(300122.SZ)、沃森生物(300142.SZ)、兰州生物制品研究所的MCV4均处于三期临床试验阶段。2021年12月,艾美疫苗和苏州微超生物的MCV4产品的临床步伐也在加快。
事件点评:
2021年是康希诺业绩爆发的一年。根据康希诺2021年三季报,公司该年1月至9月实现营业收入30.86亿元,同比增长54286.51%;实现归属净利润13.34亿元,首次实现盈利。
令其收入大增和名声大噪的,当属2021年2月获附条件上市批准的新冠疫苗克威莎。但随着疫苗接种率的提高和新冠特效药的横空出世,疫苗股热度不及2021年年初。其中,以腺病毒载体为技术路线的克威莎在加强针接种时面临推广的不确定性,导致全年股价遭遇下挫。
尽管如此,康希诺的加强针及吸入剂型仍被认为是公司的业绩增长点。可以预见,克威莎疫苗获得WHO的EUL认证、吸入剂型疫苗的国内紧急使用,或都是投资者关注的关键节点。
至于新冠疫苗光环后的其他产品,截至目前,除了克威莎,康希诺还有3款疫苗产品获批上市,分别是2017年获批的埃博拉疫苗,2021年6月获批的A群C群脑膜炎球菌多糖结合疫苗(CRM197载体)(MCV2)和近期获批的MCV4。
据公司预测,国内的脑膜炎球菌疫苗市场将随着结合疫苗的推出而迅速增长,MCV2有望进入国家免疫规划成为免疫规划疫苗,MCV4则将在非免疫规划疫苗市场占据较大市场份额。
《掘金创新药》栏目研究员认为,在辉瑞制药和康希诺的两股销售力量之下,康希诺MCV2和MCV4有望在新生儿市场有较大收获。
此外,康希诺还有6款在研疫苗已经进入临床阶段,其中13价肺炎疫苗处于临床Ⅲ期阶段,未来有望丰富公司产品品类。

2.国内“首个”新药接连获批 恒瑞医药已上市创新药达10款
2022年1月3日,恒瑞医药公告称,公司的两款药物——脯氨酸恒格列净片、羟乙磺酸达尔西利片获批上市。二者均属于化学药品1类,前者是一种SGLT2抑制剂,适用于改善成人2型糖尿病患者的血糖控制;后者是一种口服、高效、选择性的小分子CDK4/6抑制剂,适用于联合氟维司群用于激素受体(HR)阳性,人表皮生长因子受体2(HER2)阴性的经内分泌治疗后进展的复发或转移性乳腺癌的治疗。
值得一提的是,脯氨酸恒格列净片是首个国产创新SGLT2抑制剂,羟乙磺酸达尔西利片是首个中国原研CDK4/6抑制剂。两款药物的获批意味着恒瑞医药的已上市创新药达到10款。
目前,恒瑞还在进行恒格列净治疗射血分数降低的慢性心力衰竭等适应症的临床试验;同时,达尔西利用于乳腺癌术后辅助治疗的III期临床也在进行。未来两款药物的适用患者有望进一步扩大。
行业洞察:
看点一
根据国际糖尿病联盟(IDF)发布的数据,预计到2045年,全球糖尿病患者总数将增至6.29亿人。这种常见的慢性非传染性疾病,已经成为全球性的公共卫生问题,也成为了一些药企的商机。
SGLT-2抑制剂正是一类新型抗糖尿病药物。从原理上看,该抑制剂通过抑制肾脏对葡萄糖的重吸收,使过量的葡萄糖从尿液中排出,降低血糖。据恒瑞医药公告,截至目前公司对脯氨酸恒格列净的相关项目累计投入研发费用约为2.7353亿元;EvaluatePharma数据库则显示,SGLT2抑制剂相关产品2020年全球销售额约76.81亿美元。
这是一片诱人的市场,但也有国内企业认为其竞争空间已经有限。
2021年12月29日,复星医药公告宣布终止子公司江苏万邦的SGLT-2新药万格列净片的研发,当时该药处于临床I期,已投入5523万元。复星医药表示这一决定“基于对该新药后续开发投入和市场价值等因素的综合评估”,认为“国内外均已有多款SGLT-2抑制剂上市、市场竞争已相对激烈”。
而据恒瑞医药披露资料,目前全球范围内的SGLT2抑制剂上市产品共8款,包括阿斯利康的达格列净、强生的卡格列净、勃林格殷格翰的恩格列净、默沙东的埃格列净、赛诺菲的索格列净,安斯泰来制药的伊格列净、中外制药的托格列净和大正制药的鲁格列净。
看点二
恒瑞医药本次获批的另一款药物——羟乙磺酸达尔西利片瞄准了乳腺癌药物市场,截至目前,公司相关项目累计投入研发费用约3.64亿元。
根据WHO国际癌症研究机构(IARC)发布的数据,2020年全球乳腺癌新发病例高达226万例,死亡68万例。中国乳腺癌发病率逐年提升,据WHO预测,2020年中国新增乳腺癌病例高达41万。
其中,女性第一高发的乳腺癌临床分类多为Luminal A型,HR+/HER2-乳腺癌,占比60%。
而CDK4/6抑制剂可以抑制细胞周期关键调节因子的过度表达,进而阻止肿瘤生长、阻止疾病发展和提高存活率。EvaluatePharma数据库显示,羟乙磺酸达尔西利片同类产品2020年全球销售额约为69.92亿美元。
据恒瑞医药披露资料,全球首个上市的CDK4/6抑制剂为辉瑞公司研发的Palbociclib(商品名Ibrance),其他已被FDA批准上市的CDK4/6抑制剂有诺华研发的Ribociclib(商品名Kisqali),礼来研发的Abemaciclib(商品名Verzenio)和G1 Therapeutics研发的Trilaciclib(商品名Cosela)。其中,辉瑞公司及礼来公司的产品已在中国获批,诺华和G1 Therapeutics(先声药业)的曲拉西利也已经分别在中国提交上市申请,再考虑到10多家国内企业已有产品走到临床阶段,未来国产CDK4/6抑制剂大概率将陷入“内卷”。
图片来源:药渡数据库
而从国内企业在CDK4/6抑制剂上的研发进度来看,药渡数据库显示,恒瑞医药的药物上市后,山东轩竹的吡罗西尼(Birociclib)进展最快,已经进入III期临床;其余国内厂商则尚处于II期或I期临床阶段。
此外,先声药业与G1 Therapeutics就CDK4/6抑制剂达成授权合作,并于2021年11月递交了注射用曲拉西利新药的上市申请。该药物可以有效降低化疗引起的骨髓抑制(CIM)的发生率,是全球首个且唯一具有全面骨髓保护功效的药物。从研发进展看,针对小细胞肺癌、三阴性乳腺肿瘤、结直肠癌、转移性乳腺癌等适应症均已进入III期临床阶段。
事件点评:
过去,恒瑞医药的创新药多采用Fast follow策略,即紧跟国际上经过概念验证的靶点,开发me-too(派生类)创新药。此次获批上市的两款药物就是典型代表,也折射出这一战略的优势和缺憾。
一方面,Fast follow的创新难度相对较小,企业可以快速拿到专利并推进产品上市。凭借这一模式,站在巨人肩膀上的恒瑞医药逐渐摆脱了单一仿制药的产品结构。新药上市前,恒瑞医药上市销售的创新药有8种,而这8种创新药支撑起了近四成的营收。未来,随着新药的商业化,创新药对恒瑞医药的收入贡献力量将更大,公司营收动力进一步转化。
但值得注意的是,Fast follow带来的价值大小取决于药物研发速度。以恒瑞医药本次上市的羟乙磺酸达尔西利片为例,2020年12月18日,齐鲁制药的哌柏西利仿制药就在国内获批上市,速度上领先一步。此外,me-too药在国际市场的竞争优势也较有限。
总的来说,目前“Fast follow”是一条帮助药企较快进行价值变现的途径,但目前产业政策强调抗肿瘤药物研发以临床价值为导向,提升创新“技术含量”,避免严重同质化。研发me-better(创制新药)和first-in-class(同类第一)药物无疑是未来趋势,对于恒瑞医药来说,其在创新和国际化转型上的动作尤其值得关注。
封面图片来源:视觉中国

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
