◎宋瑞霖认为,医药创新的第一要义是以临床价值为导向,解决社会需求和填补空白;要以患者获益为中心,不能为了创新而创新。“只要你满足这两条,就是中国医药行业需要的创新。”
每经记者|岳琦 每经实习记者|林姿辰 每经编辑|宋思艰
近年来,中国创新药研发管线呈井喷式爆发,中国医药行业却面临创新之困。
中国医药创新目前处于什么水平?与国际的差距体现在哪些方面,该如何补足?作为创新研发的活水源,资本市场的投资风向如何,是否和创新成为一对合拍的伙伴?
点状问题铺展成面,直指医药产业政策的拓新。9月26日,在第六届中国医药创新与投资大会上,中国药促会执行会长宋瑞霖接受《每日经济新闻》记者采访时表示,中国医药创新发展迅速,不少政策并没有真正地、完全地跟上同步,未来需要不断完善的领域非常大。
根据宋瑞霖提供的数据,2016年至2020年,中国医药在研产品的全球贡献率从4.1%跃升至13.9%,仅次于美国位列全球第二;上市新药的全球贡献率从2.5%增长到6%,增长140%,迈进全球医药创新研发的第二梯队。
但原始创新还远远不够。宋瑞霖称,国内的基础研究存在很多“卡脖子”的短板,经费投入不足、研究所需的核心资源供产受限,使基础研究的基底较为薄弱;同时,各创新主体的科研成果转化能力不足。
“我们的专利权贸易的费用、专利数量非常大,但在医药方面的PCT(专利领域的国际合作条约)只占到7%,专利使用费的贸易还不如韩国。”宋瑞霖说,在国际范围内,中国医药知识产权转化产出不足,医药专利的贡献偏低。

中国医药创新专利总占比偏低 图片来源:实习记者 林姿辰 翻拍自演讲PPT
一面是研发管线井喷爆发,一面是专利转化力度不足,自然引出中国医药创新之困:什么是真正的创新?
宋瑞霖提出一个定义。他认为,医药创新的第一要义是以临床价值为导向,解决社会需求和填补空白;要以患者获益为中心,不能为了创新而创新。“只要你满足这两条,就是中国医药行业需要的创新。”
事实上,在这一基本定义之下,业界对于医药创新的讨论会更加细化,也存在一些争议。以医药创新的模式为例,资本市场更加青睐通过自研或license out(授权许可)将产品推出国门的创新药企,前几年备受热捧的license in(授权引进)的模式似乎黯然失色,与me-too药(仿制药)一同显露出创新成色不足之嫌。
对此,宋瑞霖表示,所有国家的医药发展路径都是从引入到输出,只输出、不引入是不现实的,并进行了一连串“灵魂发问”——“(授权引进)这一页翻不过去,因为我们要融入到全球的医药研发当中。如果没有license in,我们怎么可能去分享全球的医药创新成果?关键是要看license in在什么阶段。企业的未来市场是国际市场,还是仅仅是中国市场?谁都希望贸易顺差,但是如果只有顺差没有逆差,这个贸易还存在吗?”宋瑞霖认为,每年有大量的license in,同时也有大量的license out,中国才会是一个真正成熟的市场。
此外,对于部分投资者看轻“me-too药”的态度,宋瑞霖并不认同,认为不能把me-too药和first in class(同类首创药)对立起来。“我对《以临床价值为导向的抗肿瘤药物临床研发指导原则》的总体方向是赞成的,但还需要更加细化。毕竟我们还有相当多未满足的临床需求,你看FDA(美国食品药品监督管理局)所批的创新药,一半以上也是me-too药。”宋瑞霖说。
2015年,国务院发布《关于改革药品医疗器械审评审批制度的意见》,中国医药行业步入发展的黄金时代,成批量的创新药开始涌现。但宋瑞霖直言,面对崭新的创新药时代,企业、政府部门过去以仿制药为基础的管理思维尚未完成转换,很多政策上的不协调亟待调整。
“现在中国医药创新发展迅速,很多政策并没有真正地完全跟上同步。”宋瑞霖表示,早期药物政策都是为当时以仿制药为代表的医药产业制定的,但创新药和仿制药存在本质不同。
从成本上看,创新药的临床实验占到研发费用的70%,一旦研发失败将具有大量的沉没成本;另一方面,为了帮助临床大夫准确地掌握药物特性并推及患者,医药代表,即医药研发的专业人员向医生介绍药物的作用机理和适应症,也是创新药必须具备的成本。
高成本往往指向高价格,但目前创新药与仿制药的定价模式接近甚至重合,宋瑞林认为并不合理。他呼吁构建多层次的医疗保障体系,在创新药纳入医保方面,建立一套针对创新药的单独支付制度。
“‘重大新药创制’科技重大专项提出以临床价值为导向,也就是说认定临床价值是研发创新药的首要一步,但如果药品研制出厂,临床价值无法变成市场价格,就会出现问题。”宋瑞霖表示,“创新药的价值是客观存在的,不能因为兜里的钱多钱少来决定”,要让商业保险、慈善和企业自身支持加入医疗保障之中,以临床价值为基础确定创新药的价格,根据支付能力来限定报销的比例,在保障医保基金安全的前提下,推动产业的发展。
除了创新药支付政策,宋瑞霖还提到目前的审评、审批能力的问题仍然有很大的空间。据CDE(国家食药监督管理总局药品审评中心)副主任周思源介绍,美国有针对小分子药品和大分子药品分设药物审评审批中心,两个中心的工作人员总共5000多人,但CDE同时担任大、小分子药物的审评、审批工作,却只有600多人;此外,审评人员的能力素质是否达到国际标准的水平,也还要打一个问号。
宋瑞霖表示,如果把药企比作汽车,医药创新的发展就是一条高速公路,期间有一个堵点就达到不了真正的目的地。“我们现在的路是通了,但不是那么通畅,还需要修改很多政策,要不断加宽路面,提升路面质量。想让车辆的流动性更好,后面的工作还有非常多。”
根据OECD(经合组织)数据库,从总量看,中国2015至2019年的研发总投入规模仅次于美国,并以9.5%的复合增长率在全球位列第一;但从GDP占比看,略低于欧美国家生物医药领先国家3%的投入水平。这两项数字说明中国医药创新研发需要雄厚资金的支持,并且这一情况在未来仍将持续。
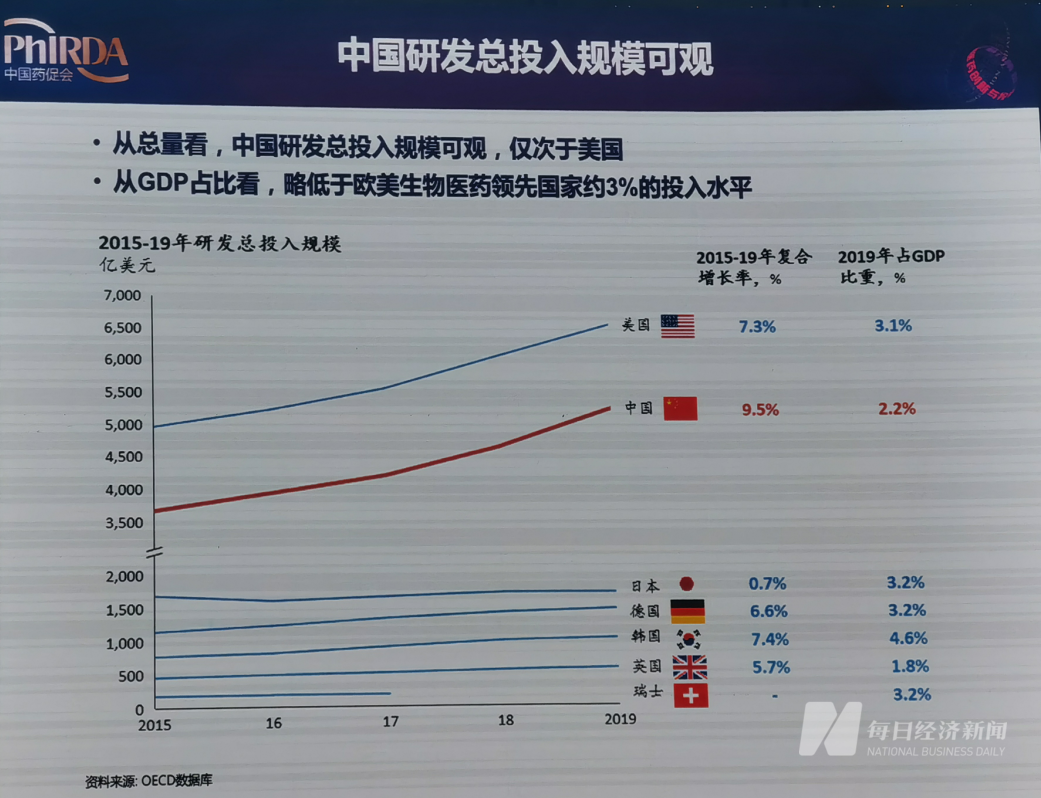
中国研发总投入规模可观但GDP占比仍有提升空间 图片来源:实习记者 林姿辰 翻拍自演讲PPT
宋瑞霖表示,目前中国处于医药创新发展的初期,行业在积极向上的同时,也出现了投资过度集中,甚至一哄而上的弊端。所以,他呼吁药企和投资者都要理性看待医药市场。
“投资不单单是赚钱或者亏钱的问题,还关系到资源的最优配置,所以不管是私募基金还是个人资产,都应该理性看待医药市场,”宋瑞霖说,2015年至2020年,中国批准上市的创新药有60多个,但其中能算上first in class的只有4个,在这种情况下,舍弃me-too药和仿制药企业并不可取。
“从投资者到申报方,要知道自己所处的赛道,找到最不堵的一条路走,而不是非要走一条拥堵的赛道。”宋瑞霖说,如果一味进行同质化的药物研究,临床专家会做大量重复性的工作,中国医药创新很难在世界脱颖而出。但他也提醒道,受试者非常小众,也不利于医药创新的发展。“总之,不要因为做了某个项目就有执念必须要做完,做不成就赶紧撤,否则对各方都不利。”
此外,对于业界关注到的新药研发成本上升问题,宋瑞霖指出其背后是动物资源、CXO(医药研发及生产外包)报价和高端人才成本上升。但目前尚有企业愿意支付高昂的成本进行研究,证明了行业创新需求非常强烈,竞争活力也非常高,业界不必太过担忧研发成本高昂。
“未来,如果北京、上海的医药研发成本持续高昂,就会成就周边具有更好优势的区域来发展生物医药和科技产业,我们没有必要用行政的手段限资限薪。还是要回归到市场,用市场机制去调整它。”宋瑞霖说。
封面图片来源:摄图网

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
