◎索元生物的7个在研药品来源皆为外采,包括礼来、奥尔巴尼、百时美施贵宝、强生等。实际上,索元生物在从事一个“捡漏”的事情,就是挑别家药企已经宣告失败的项目再进行操作,而其中核心关键点就在于能否找到“生物标志物”。
◎索元生物的核心产品,也是募投金额最多的产品是DB102。对于该产品,索元生物称已经发现了生物标志物。“截至本招股说明书签署日,公司核心产品DB102对应的2项研究正处于III期临床试验阶段,距离提交新药上市申请仍需一段时间,在此过程中可能会面临药品注册审评制度的变动”。
每经记者|赵李南 每经实习记者|林姿辰 每经编辑|陈俊杰
杭州索元生物医药股份有限公司(以下简称索元生物)近期递交了招股书(申报稿,下同),拟在科创板IPO,募集资金16亿元。
《每日经济新闻》记者注意到,索元生物颇有一些特殊之处,按照公司说法,其是一家以高效的精准医疗技术开发多款面向全球市场的首创新药(First-in-class)的生物医药公司。而索元生物的特殊性就体现在其所有的研发管线皆是靠外采,而其中不乏有长达6年的外采研发项目尚未取得实质研发进展的情况。
此外,截至2020年底,索元生物总计有员工数43人,其中境内员工数12人。
2018年度至2020年度,索元生物实现营业收入分别为0、10.35万元和10.35万元;实现归属于母公司所有者的净利润分别约为-1亿元、-1.34亿元和-2.23亿元。
索元生物表示:“发行人处于新药研发阶段,核心产品尚未取得上市许可,未发生与其核心产品相关的销售。报告期内,发行人的收入均为DB102商业化开发许可的期权费收入。”
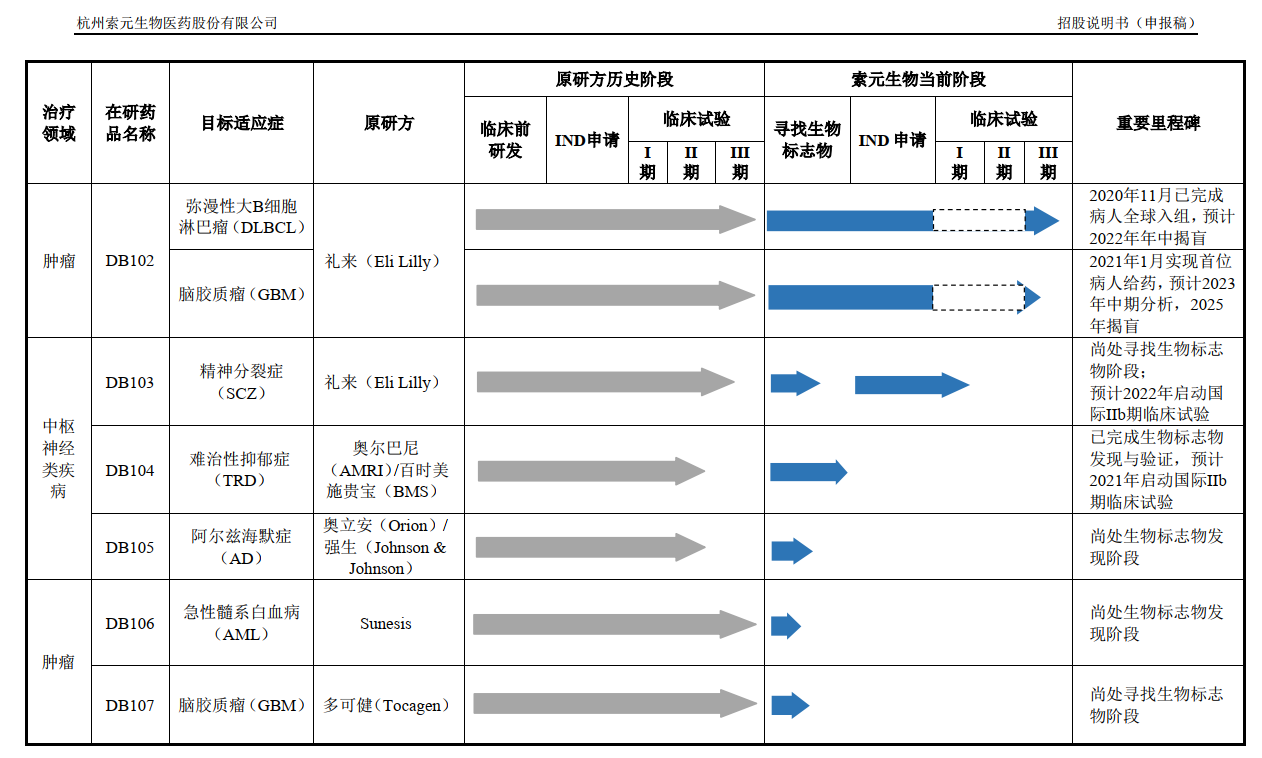
索元生物所提及的DB102是其研发管线中的一个,公司以编号的方式命名研发管线,除此之外还有DB103、DB104、DB105、 DB106、DB107、DB108。
图片来源:索元生物招股书截图
值得注意的是,索元生物的7个在研药品来源皆为外采,包括礼来、奥尔巴尼、百时美施贵宝、强生等。
对于为何没有自主研发的药品,索元生物表示:“公司针对未满足临床需求的重大疑难病症,如肿瘤及中枢神经类疾病,收购或引进后期临床试验失败但已证明其安全性且显示对部分患者有效的创新药,并获得该等创新药的全球或全球绝大部分地区权益。通过公司独特的生物标志物发现平台,寻获到经独立验证的可预测药效的生物标志物,进而重新开展以生物标志物为指导的国际多中心临床试验,最终开发出面向全球市场的创新药。”
换句话说,索元生物在从事一个“捡漏”的事情,就是挑别家药企已经宣告失败的项目再进行操作,而其中核心关键点就在于能否找到“生物标志物”。
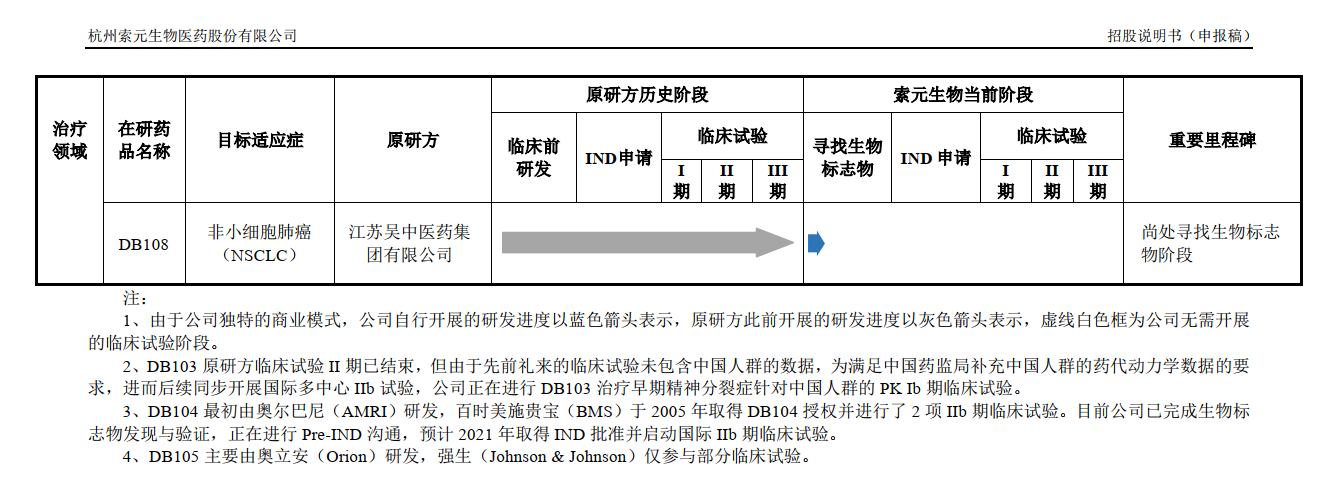
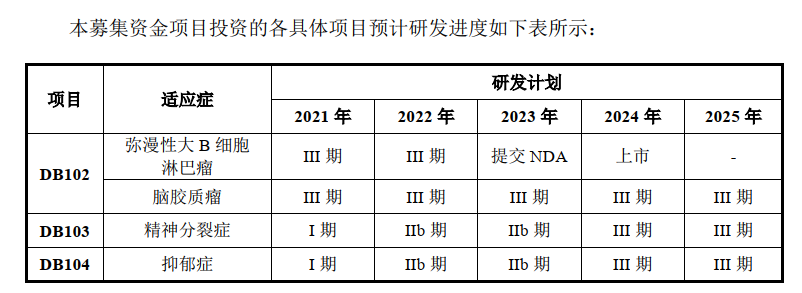
在前述的研发药品中,DB102、DB103和DB104是索元生物的募投项目,拟募集投入的资金分别约为6亿元、2.7亿元和7亿元。
图片来源:索元生物招股书截图
《每日经济新闻》记者了解到,DB103的化合物名称为Pomaglumetad Methionil,是礼来原研的抗精神分裂药物,临床III 期试验未达预期效果。
索元生物针对该药的研究还停留在“寻找生物标志物阶段”,“目前DB103正处于寻找生物标志物阶段。公司已完成DB103 相关样本的全基因组扫描,正在进行全基因组扫描结果分析”。
事实上,早在2012年8月,礼来就已经宣布停止对pomaglumetad methionil的研发。而索元生物虽然没有在招股书中披露对DB103的引入时间,但却在其美国子公司官网上的新闻稿中披露了该药物的引入时间为2015年3月。
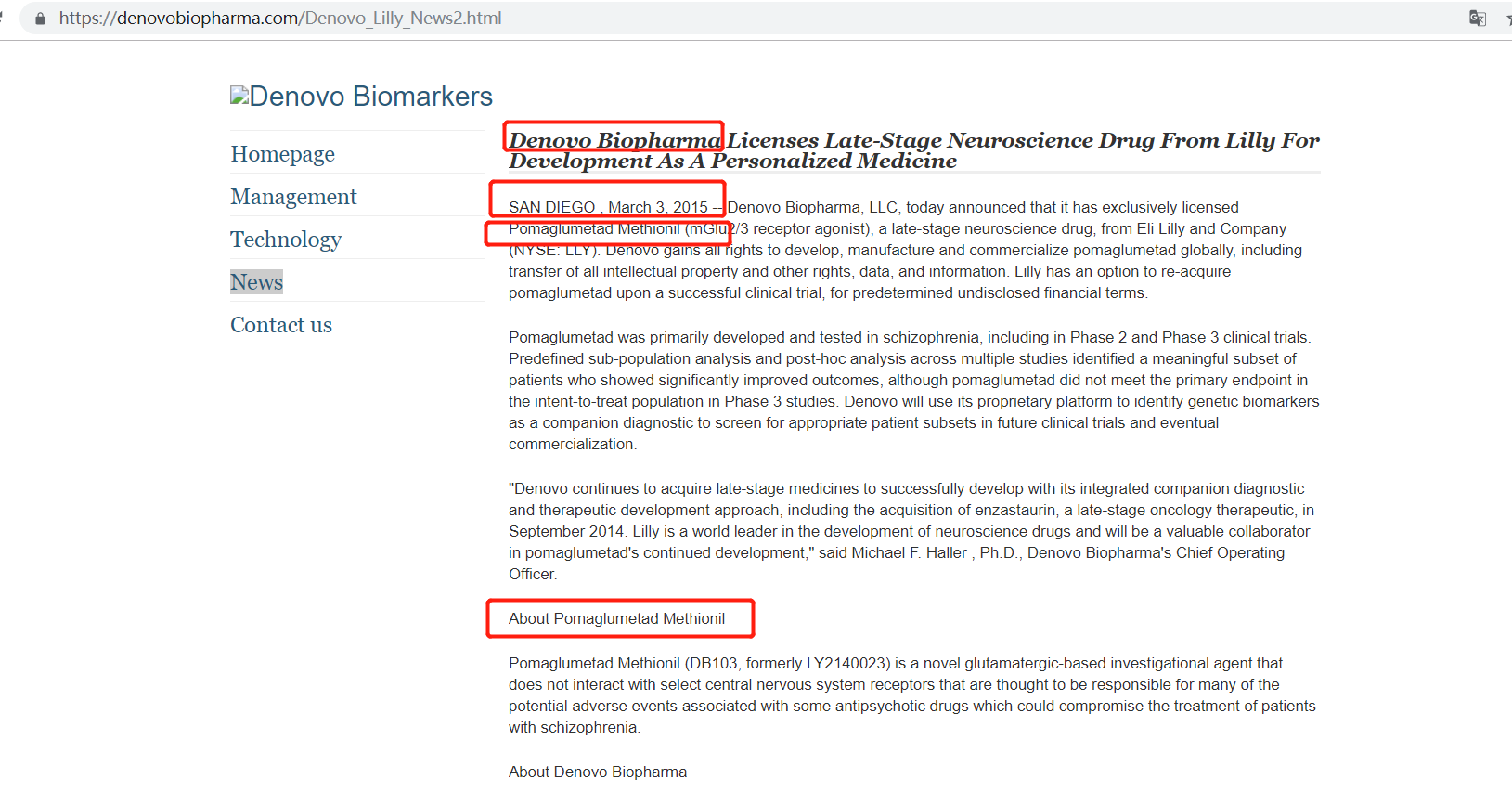
图片来源:索元美国官网截图
在上述新闻稿中,索元生物表示:“Pomaglumetad主要在精神分裂症中开发和测试,包括在2期和3期临床试验中。多项研究中的预定义亚群分析和事后分析确定了一个有意义的患者子集,这些患者显示出显著改善的结果,尽管pomaglumetad在3期研究中未达到意向治疗人群的主要终点。索元生物将使用其专有平台来识别遗传生物标志物作为伴随诊断,以在未来的临床试验和最终商业化中筛选合适的患者亚群。”
换句话说,在2015年3月,索元生物取得DB103的许可之时,便已经要进行“生物标志物”的识别研究,而迄今为止,这个识别已经跨越了6年还未有成果。
相比之下,索元生物已经宣称发现的DB102的生物标志物DGM1,DB104的生物标志物DGM4所花费的时间都未超过4年。
针对DB103的研究进展问题,索元生物方面向《每日经济新闻》记者表示:“公司于2015年收购DB103,目前DB103正处于寻找生物标志物阶段。公司发现潜在生物标志物的阶段,是一个极为复杂的原创科学发现的过程,需要依赖药学、临床医学、分子生物学、生物信息学、基因组学、遗传学和统计学等各方面专家的紧密合作,需要极强的专业知识和技术诀窍(即Know-how)。此外,中枢神经系统疾病发病机制尤为复杂、临床效果较难评测,均增加了中枢神经系统疾病相关药物的生物标志物发现的难度。相对于肿瘤领域精准医疗的突飞猛进,目前在中枢神经疾病创新药研发领域,全球范围内尚未有可预测药效药物基因组生物标志物的获批上市,还未实现零的突破。尽管公司运用其生物标志物开发平台为肿瘤新药成功发现生物标志物,DB103是公司第一次尝试将该平台用于中枢神经疾病。”
此外,索元生物还表示:“自公司完成DB103全球授权及技术转移以来,公司运用了多种组学手段进行了全基因扫描,并开发了多种针对中枢神经类疾病的新的算法来进行大规模数据分析。正是受益于进行DB103项目时开发出的新算法及对中枢神经类疾病临床试验终点的了解,公司通过其独特的生物标志物发现平台,于2019年发现了一个全新的与中枢神经系统领域另外一款药物DB104降低抑郁症主要临床指标MADRS评分的高度相关的生物标志物,命名为DGM4(Denovo Genomic Marker 4)。”
索元生物的核心产品,也是募投金额最多的产品是DB102。对于该产品,索元生物称已经发现了生物标志物。
“截至本招股说明书签署日,公司核心产品DB102对应的2项研究正处于III期临床试验阶段,距离提交新药上市申请仍需一段时间,在此过程中可能会面临药品注册审评制度的变动。”索元生物表示。
在招股书中,索元生物对该药品III期临床试验的进度相应表述为:“DB102 正在中国和美国同步开展国际多中心,一线治疗弥漫性大B细胞淋巴瘤(DLBCL)III期临床试验研究,已于2020年11月完成国际多中心临床III期病人入组,预计将于2022年年中揭盲。”
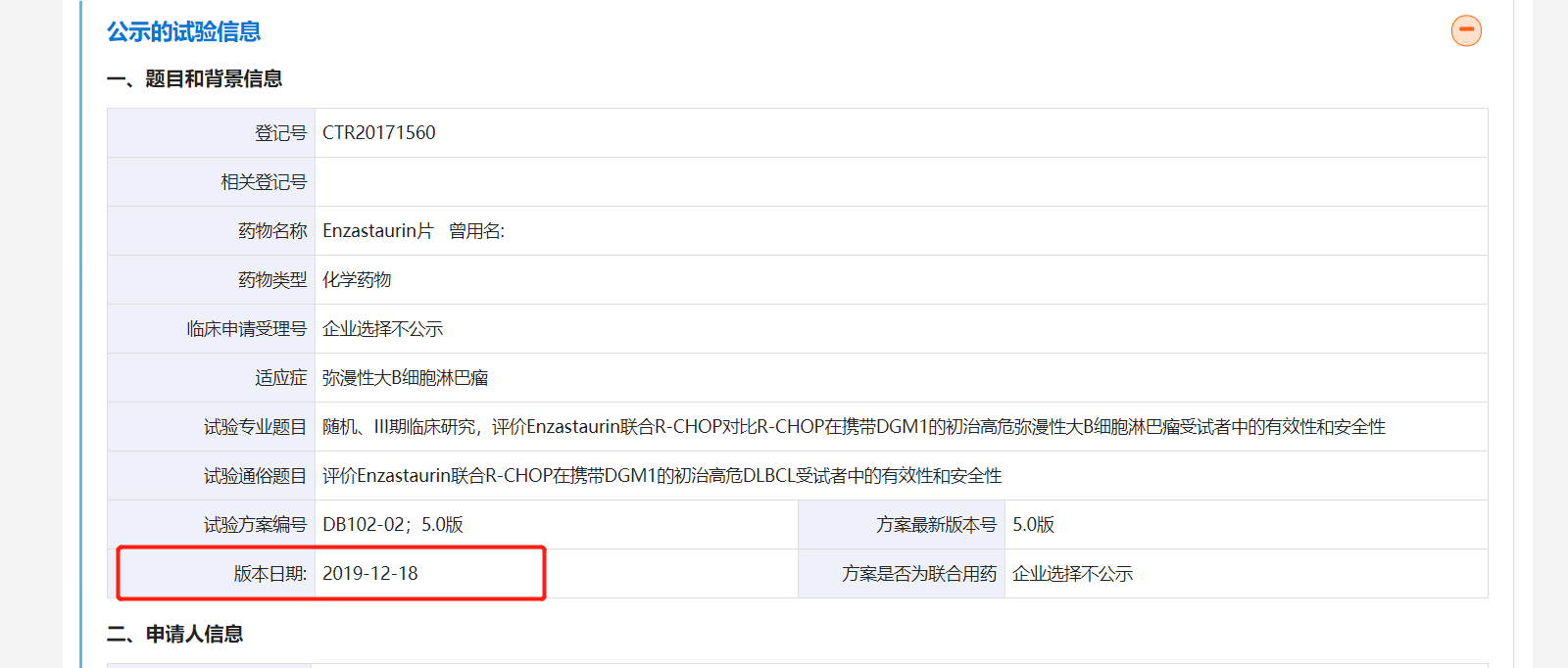
事实上,索元生物仅在招股书中描述了DB102的III 期临床试验完成入组时间,但并未公布该III期临床试验的开始时间。《每日经济新闻》记者发现,在药物临床试验登记与信息公示平台公示的信息显示,DB102的III期临床试验早在2018年3月就已经开始,迄今为止已经有3年半的时间。
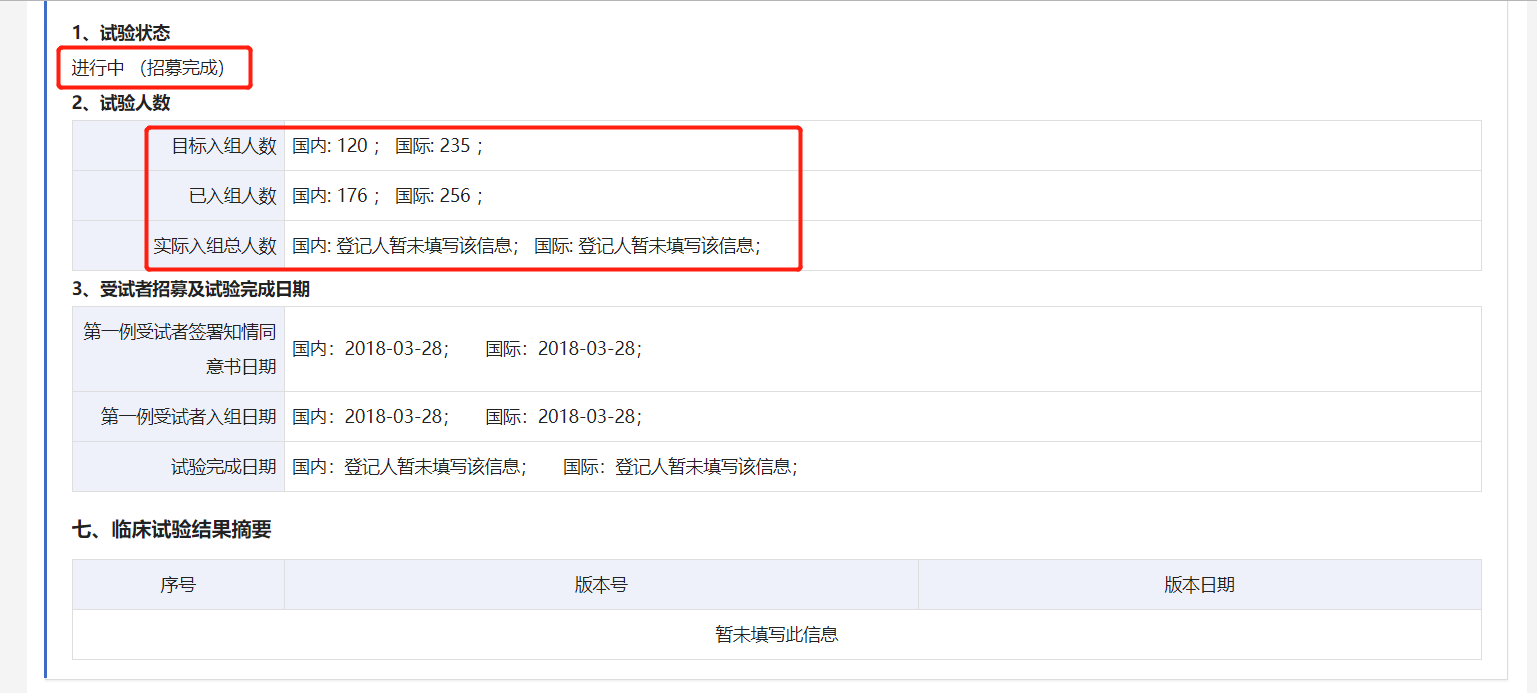
值得注意的是,编号为CTR20171560的DB102 III期临床试验在2019年12月18日版本的公示信息中,已经显示“招募完成”,目标入组人数为国内120人,国际235人;已入组人数为国内176人,国际256人。
图片来源:药物临床试验登记与信息公示平台截图
为何该三期试验已经持续了相当长的时间还未有结果?《每日经济新闻》记者向索元生物发送了采访函。
索元生物回复称:“DB102正在中国和美国同步开展国际多中心一线治疗弥漫性大B细胞淋巴瘤(DLBCL)III期临床试验研究,主要疗效终点是DGM1生物标志物阳性受试者的OS(OS是指从随机分组日期至任何原因死亡日期之间这段时间)。在肿瘤领域,有OS、PFS、TPP、TFF、ORR、DCR、DDC等各项评价指标。其中OS被认为是肿瘤临床试验中最具有临床价值的疗效终点,所以它是本试验的首要临床终点。但是采用OS会导致临床试验持续时间较长。相比于其他恶性肿瘤,DLBCL中位OS相对较长,如果以OS为临床主要终点,临床试验通常需要较长时间,例如跟本实验较为类似的礼来的一线治疗DLBCL的临床II期临床试验用了近5年时间。”
索元生物表示:“该研究于2018年初展开,已于2020年11月完成国际多中心临床III期病人入组,目前该试验的揭盲时间受到终点事件(受试者死亡)发生的速度等各种因素的影响,预计将于2022 年年中揭盲,从全球多中心III期临床试验展开到揭盲预计耗时4年多。”
8月6日,该试验的中国总协调研究者,北京肿瘤医院教授朱军向记者表示:“这个实验我们还没有揭盲,刚刚完成入组,正在收集数据整理待批,所以说这个实验算是入组结束,但是数据的整理还没完。原计划5年,基本按计划(进行),对这个试验有信心。”
封面图片来源:摄图网

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
