每经记者|金喆 每经编辑|陈俊杰
国家药品监督管理局药品审评中心数据显示,7月1日~7月15日,共承办610例申报进度,其中受理化药申请438项,生物制品申请152项,中药申请15项,未注明分类5项。
《每日经济新闻》记者分析得知,本阶段有三个与药物研发相关的消息备受关注。一是7月15日君实生物登陆科创板,4个交易日股价腰斩,引发市场对未盈利的生物制药企业千亿估值的探讨;二是人福医药获得1类麻醉新药注射用苯磺酸瑞马唑仑的注册证书,临床用药又将迎来重磅品种,也会在未来对恒瑞医药带来直接竞争;三是新冠肺炎疫苗的研发进展依然是市场重点关注的方向。

半月要闻
1、君实生物-U(688180,SH)登陆科创板
7月15日,君实生物在科创板挂牌上市,是科创板第28家生物医药企业,也是创新药“新三板+A+H”第一股。君实生物首次公开发行A股募集资金净额为44.97亿元。
受关注指数:五颗星
每经点评:君实生物这两年自带流量,7月15日登“科”当天股价一度冲到220.40元/股,但连续4天振幅后股价腰斩,而港股股价也在过去几天跌幅超过20%,这引发了市场对君实生物的探讨:君实生物究竟是黑马还是白马?
讨论生物制药企业的市值,主要是两个指标,一是明面上的财务数据,这是公司实实在在的业务,二是公司的产品研发管线,这是公司未来的东西。但我们也看到,最近两年生物制药企业在资本市场风生水起,市盈率早就成了市梦率,在君实生物身上也是如此。
为什么这么说?先看财务指标。2013-2019年,君实生物连续亏损19亿元,目前唯一的造血产品是2018年12月获批的特瑞普利单抗注射液(商品名:拓益),国内首个获批上市的国产PD-1单克隆抗体注射液,也是获批的6款PD-1单抗类药物中价格最低的产品。
虽然如此,拓益还是面临激烈的竞争,市场分析如下。
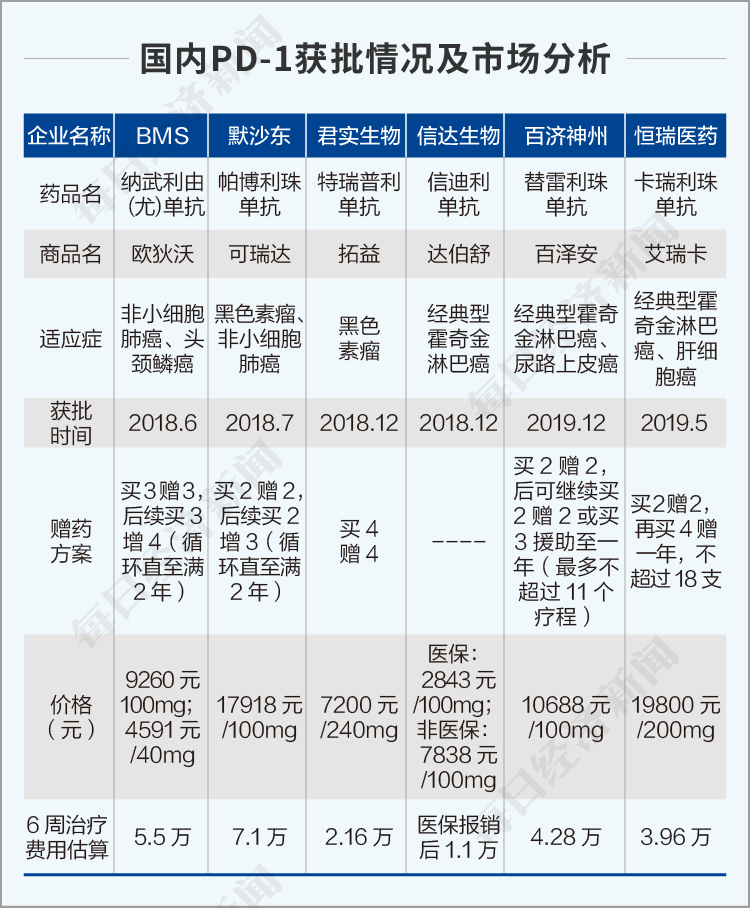
对于PD-1的激烈竞争,君实生物在招股书里说得很直白——目前,各个国产PD-1药物,每个疗程费用相当,公司产品和其他国产PD-1药物产品相比不具有明显价格优势。尽管PD-1产品价格体系暂未受到冲击,但发行人在市场推广、分销准入等方面面临激烈的竞争,未来如果竞品的定价出现大幅下降,公司也将视纳入医保的情况和市场情况综合考虑价格调整。但是,我们都知道,目前只有信达生物的达伯舒纳入医保。
PD-1的主要竞争还有在研的适应症赛道,最大的适应症是肺恶性肿瘤,君实生物开发了三个适应症,均已启动3期临床。君实生物目前的研发管线中,有4大病种、13个在研药物、23个适应症处于开发阶段。有5个生物药品正在临床阶段,8个处于临床前研究。

其中最受关注的产品是UBP1211,一款与泰康生物合作开发的修美乐生物类似药;以及用于治疗心血管疾病的注射用重组人源化抗PCSK9单克隆抗体。根据方正证券的数据,君实生物的特瑞普利、修美乐生物类似药和PCSK9抑制剂三大核心产品约有超过230亿元的估值。
显然,君实生物过去几天在科创板的表现已经表明了市场的态度,创新药企业的合理估值究竟在哪里?热炒背后是对中国创新药春天的期待还是在资本市场割韭菜?我们只能拭目以待,毕竟罗马非一日建成,创新药研发也是漫长而痛苦的过程,但我们也鼓励更多的中国药企走上创新道路,推动更多更先进的药物上市。
2、人福医药1类麻醉新药注射用苯磺酸瑞马唑仑获批上市
7月15日,宜昌人福药业1类新药注射用苯磺酸瑞马唑仑的上市申请(受理号 CXHS1800035)状态变更为“在审批”,7月20日晚间人福医药(600079,SH)公告称,获得药品注册证书。
受关注指数:五颗星
每经点评:镇静、镇痛、肌松是麻醉管理的三要素,目前常用镇静药物有丙泊酚、咪达唑仑,但丙泊酚具有明显的呼吸抑制、心血管抑制作用,咪唑安定无镇定作用。注射用苯磺酸瑞马唑仑就是临床理想的静脉麻醉药物,具有起效快、可控性好、代谢产物无活性等特点,基本可以在临床中替代丙泊酚。
据丁香园Insight数据库,人福药业就苯磺酸瑞马唑仑在国内共登记7项临床试验,适应症覆盖麻醉诱导与维持、治疗或诊断性操作时的镇静,本次获批的适应症为结肠镜检查的镇静。
这意味着,恒瑞医药的1类新药甲苯磺酸瑞马唑仑将迎来强劲的对手。据了解,甲苯磺酸瑞马唑仑也是瑞马唑仑的改盐化合物,2019年12月国内获批用于胃镜检查镇静,今年6月30日又获批新适应症用于结肠镜检查的镇静;丁香园Insight中标数据显示,恒瑞瑞马唑仑最新中标价为266元/瓶(36mg)。
3、复宏汉霖曲妥珠单抗生物类似药即将获批
7月7日,复宏汉霖曲妥珠单抗生物类似药在完成两轮补充资料、生产现场检查、临床试验现场核查后,预计近期即将获批上市,成为首个国产曲妥珠单抗生物类似药。
受关注指数:四颗星
每经点评:曲妥珠单抗原研是罗氏的王牌品种赫赛汀,长期占据了药物销售TOP10的名单,2019年全球销售额近60亿瑞士法郎,同比下降13.5%。
目前,曲妥珠单抗已在国内获批多个适应症,包括HER2阳性的转移性乳腺癌,HER2阳性的早期乳腺癌的辅助、新辅助治疗,HER2阳性晚期胃癌以及超适应用药于HER2阳性非小细胞肺癌。
数据显示,HER2阳性乳腺癌约占全部乳腺癌的20%~30%,具有恶性程度高、病情进展迅速、易发生淋巴结转移等特点。目前,曲妥珠单抗已被国内外乳腺癌诊疗指南推荐用于HER2阳性乳腺癌患者各阶段的治疗,成为HER2阳性乳腺癌患者全程规范化治疗公认的“金标准”用药。
2017年赫赛汀纳入医保后,由原本每瓶21613元降价至7600元,降价幅度达 65%,2019年中国境内的销售额约35亿元。价格依然昂贵,可负担的患者受限;根据弗若斯特沙利文报告,2018年中国仅有约25%符合条件患者能够负担赫赛汀的费用。
丁香园Insight数据库显示,目前国内还有13家企业在研,共有7家企业已经进入III期临床,分别是上海生物制品研究所、嘉和生物、正大天晴、华兰基因工程、海正药业、安科生物、SAMSUNG BIOEPSIS的类似药处于3期临床。
我们期待复宏汉霖尽快抢到国产曲妥珠单抗生物类似药的“出生证”,让更多希望能够用上这款药物的患者使用这款药物。
半月动向
《每日经济新闻》记者统计得知,本阶段生物制品企业延续了6月份的研发热情,申报量继续创新高。而申报的一类药物数量也创新高,达到52种,具体情况如下图所示。
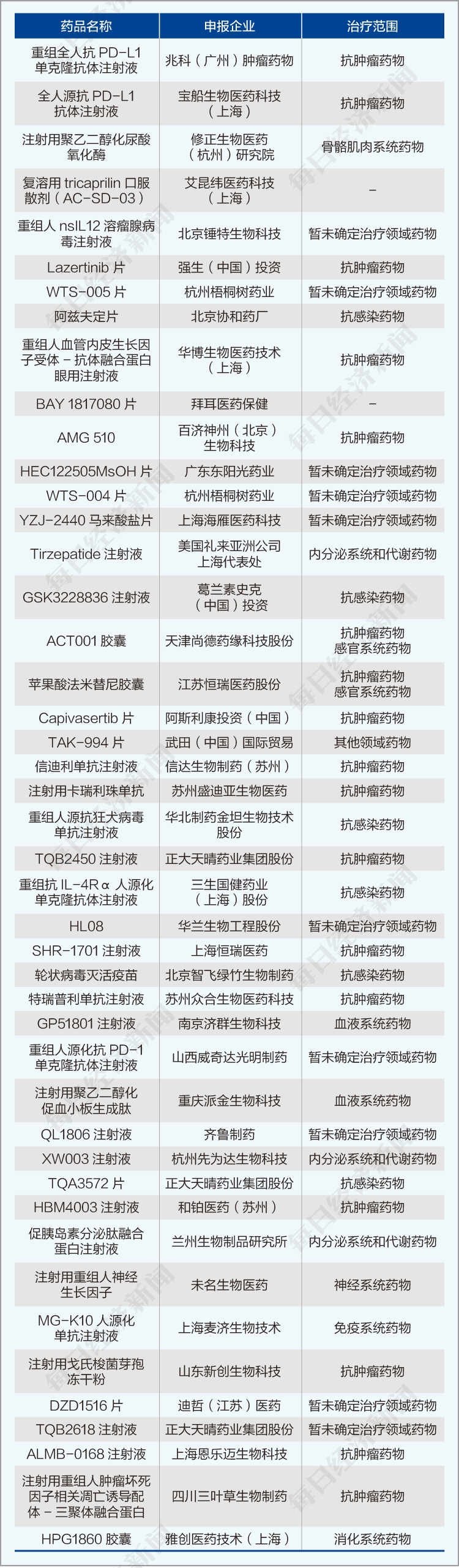
但同比之下,本阶段获批的首次上市产品只有1种,为南京正大天晴制药有限公司的碘帕醇注射液(规格为100ml:37g(I)),属于医学影像学药物。其余17种为再注册品种。
封面图片来源:摄图网

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
