2024年,诺诚健华总收入达到10.09亿元,同比增长36.7%;归属于上市公司股东的净利润为-4.41亿元,上年同期亏损6.31亿元。奥布替尼(商品名:宜诺凯)作为公司核心商业化产品,全年销售额首次迈过10亿元大关,较2023年增长49.14%。
每经记者 林姿辰 每经编辑 董兴生
近日,诺诚健华(SH688428)发布2024年年报,其核心产品奥布替尼在上市4年后,终于迈过了年销10亿元的大关。而且,公司预计奥布替尼一线治疗慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)的适应症将于2025年获批,第二款商业化产品Tafasitamab(坦昔妥单抗)将于今年上半年在国内获批。
《每日经济新闻》记者注意到,随着研发管线接近商业化,不少Biotech(生物科技公司)降本增效,缩减研发团队。但3月28日,诺诚健华方面对《每日经济新闻》记者表示,公司目前没有缩减研发团队的计划,但会持续提升销售效率。
公司还表示,2024年研发费用的增加,主要源于持续推进重要管线的全球临床试验和加大早研技术平台投资。2025年上半年,公司将提交首款ADC(抗体药物偶联物)药物ICP-B794的IND(临床试验申请)。
2024年,诺诚健华总收入达到10.09亿元,同比增长36.7%;归属于上市公司股东的净利润为-4.41亿元,同比收窄30.20%,上年同期亏损6.31亿元。奥布替尼(商品名:宜诺凯)作为公司核心商业化产品,全年销售额首次迈过10亿元大关,较2023年增长49.14%。
对于奥布替尼的收入增长,公司表示主要归功于边缘区淋巴瘤(MZL)适应症纳入医保后,2024年实现快速放量,以及商业化团队能力不断加强。
记者注意到,过去三年,奥布替尼的销售额增速分别为163.63%、18.52%、49.14%。目前,奥布替尼的3项适应症均已纳入国家医保目录,且是国内首个且唯一获批针对复发或难治性MZL适应症的BTK抑制剂。但由于这些适应症均为二线疗法,市场规模相对有限。
一线疗法何时获批,是投资者最关注的事项之一。去年8月,奥布替尼一线治疗慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)的新药上市申请获受理,在2024年年报中,诺诚健华预计该适应症将于2025年获批。
另外,公司还预计第二款商业化产品Tafasitamab(坦昔妥单抗)将于2025年上半年在内地获批。这款靶向CD19的人源化单克隆抗体药物,主要用于治疗复发或难治性弥漫大B细胞淋巴瘤(DLBCL),目前已获批在大湾区及博鳌超级医院作为临床急需进口药品使用。
基于这两项申报获批预期,诺诚健华今年有何销售目标?诺诚健华方面对记者表示,首先,公司将继续发挥奥布替尼独家适应症MZL的优势,加快拓展市场,不断提升MZL适应症在奥布替尼销售中的占比;第二,一线CLL/SLL的获批上市将成为奥布替尼销售的重要催化剂,促进销售再上新台阶。此外,公司的销售费用率已经从2023年的55%下降到2024年的42%,公司将持续提升销售效率。
无论是奥布替尼,还是坦昔妥单抗,都体现着诺诚健华对血液瘤管线的重视。根据公司年报披露的在研产品管线,除了奥布替尼,坦昔妥单抗治疗方案上市申请已获受理,ICP-248(mesutoclax)联合奥布替尼一线治疗CLL/SLL的III期临床试验已经启动,三者构成公司在血液瘤领域的基本盘。
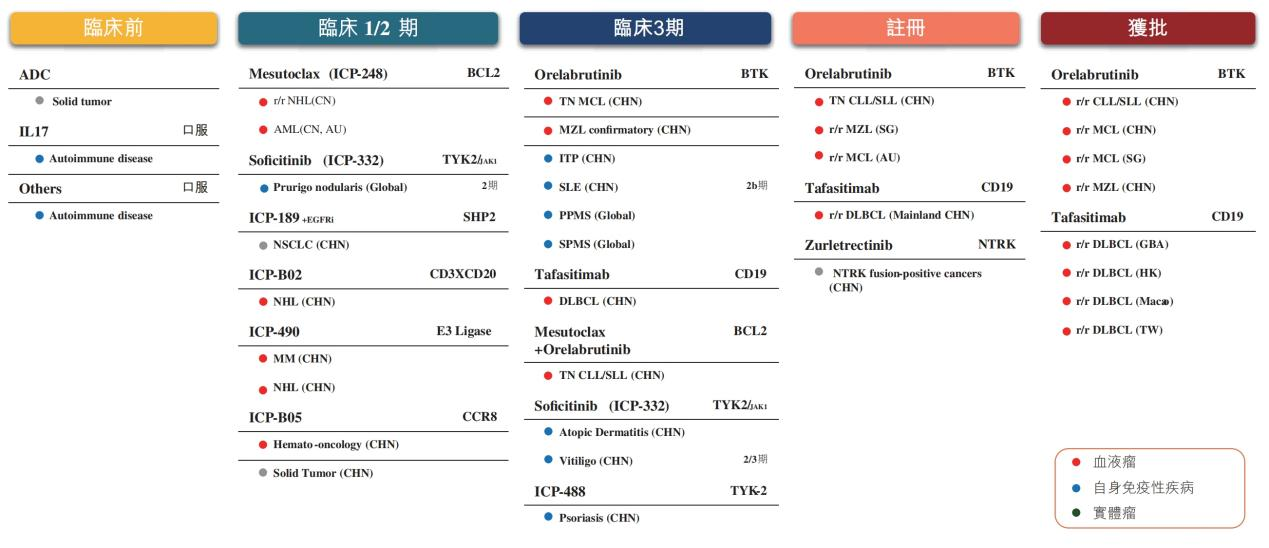
诺诚健华在研产品 图片来源:公司2024年年报
但从临床项目看,公司希望将自身免疫性疾病管线打造成第二增长曲线。具体来说,奥布替尼针对免疫性血小板减少症(ITP)、系统性红斑狼疮(SLE)、原发进展型多发性硬化症(PPMS)、继发进展型多发性硬化症(SPMS)的试验正处于临床3期阶段,ICP-332治疗特应性皮炎(AD)的3期临床试验正在推进,治疗白癜风的2/3期临床试验正在进行中,ICP-488治疗中重度斑块状银屑病的3期注册临床试验在中国完成首例患者给药。
其中,最引人注意的,是奥布替尼去年9月在美国获批启动治疗原发进展型多发性硬化(PPMS)的III期临床研究。自2023年渤健决定“为便利而终止”(Terminate for Convenience)双方的授权合作和许可协议后,诺诚健华重新获得此前授予渤健的所有全球权利,自行推进相关管线在海外的临床试验。
此外,公司还在加快研发管线的全球化。今年1月,公司携手康诺亚和Prolium Bioscience达成许可合作,授权Prolium开发和商业化CD20×CD3双特异性抗体ICP-B02(CM355)。根据协议条款,Prolium将获得在全球非肿瘤领域以及亚洲以外肿瘤领域开发、注册、生产和商业化ICP-B02的权利。诺诚健华和康诺亚将获得最高5.2亿美元的总付款,且二者将获得未来产品净销售额的分层特许权使用费。
记者注意到,这是继2021年和渤健的BD(商务合作)后,诺诚健华公开宣布的第二项BD。诺诚健华方面对记者表示,公司正在积极探索重要管线的国际合作和对外授权,扩大公司在中国市场以外的业务合作。与此同时,公司将持续加强在关键市场的临床开发和注册事务能力,目前已经在欧美组建了临床开发及注册团队。
封面图片来源:每日经济新闻 刘国梅 摄

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
