◎伦敦大学学院细胞与基因治疗教授瓦西姆·卡西姆对每经记者表示,“成本、时间以及所需的特殊实验室是目前(推广CAR-T疗法)的主要障碍。不过,预计未来出现的新技术可能应该能帮助解决其中一些问题。”
每经记者|文巧 每经编辑|兰素英
在一间白色的实验室里,一位年轻的医生正小心翼翼地向从白细胞中分离出的T细胞加入特异性嵌合抗原受体(CAR)基因,将其修饰为CAR T细胞,随后将其置于实验室中生长和繁殖,等待它们被转化为能够识别并消灭癌细胞的“超级战士”。
这就是CAR-T疗法,一种利用基因工程技术改造人体自身免疫细胞的革命性肿瘤治疗方法,为无数有血液类癌症的患者带来了新的希望。自2017年以来,FDA已批准六种CAR-T细胞产品用于治疗晚期复发或难治性血癌患者。其中,吉利德的产品Yescarta的销售额在今年第三季度高达3.91亿美元。
然而,这一新兴疗法也面临着一些挑战和风险,如安全性问题。在2023年11月底,美国食药监局(FDA)宣布,已收到19份报告称患者在接受CAR-T治疗后患上了一种T细胞恶性肿瘤,该机构正在对相关风险进行调查。
但不可否认,CAR-T细胞疗法仍是生物科技产业版图中最具潜力的赛道之一,市场也期待着其作为癌症治疗的破局者。根据国外研究公司Precedence Research的数据,2022年全球CAR-T细胞治疗市场规模为38亿美元,预计到2032年将达到885.2亿美元左右,2023年至2032年复合年增长率将高达29.8%。
目前,CAR-T细胞疗法主要针对血液性癌症,该技术还存在哪些技术难题?下一个前沿领域又在何处?《每日经济新闻》记者就此采访了伦敦大学学院细胞与基因治疗教授瓦西姆·卡西姆(Waseem Qasim)。他曾在2022年主导了全球首次针对复发性T细胞白血病患者的碱基编辑细胞疗法治疗。

伴随着科学家们对癌症病理生理和发病机制更深入的理解,癌症治疗已进入一个新时代——从传统以手术、放化疗为基础的治疗过渡到以个体化精准化的靶向治疗和安全性及效能更高的免疫治疗。而嵌合抗原受体修饰T细胞(Chimeric antigen receptor modified T cells, CAR-T cells)疗法则是发展最为迅速的一种过继性细胞免疫治疗。
CAR-T疗法通过提取患者自身的T细胞,再利用基因工程技术将一种特殊的受体——嵌合抗原受体(CAR)引入到T细胞中。这些经过改造的T细胞被重新输回患者体内,能够识别并攻击携带特定抗原的癌细胞。T细胞除了来自患者自身之外(自体),也可以从其他健康供体中采集(同种异体)。
瓦西姆·卡西姆在向记者解释该疗法的技术原理时说道,“T细胞是白细胞,是我们免疫系统的重要组成部分。通常情况下,它们的作用是抵抗感染,并杀死受感染的细胞,还可以攻击某些类型的癌症。”
“在CAR-T疗法中,我们收集这些细胞,并使用‘基因疗法’对其进行改造。在这种情况下,CAR-T细胞被设计为仅针对一个目标具有活性,能够识别这个目标细胞表面的标志,然后杀死该细胞。”他进一步解释道。
瓦西姆·卡西姆目前还在伦敦大奥蒙德街儿童医院从事血液和骨髓干细胞移植方面的工作。他告诉记者,血液和骨髓干细胞中有非常多的T细胞,在20多年的从业生涯中,他及其团队已经积累了如何收集和修饰T细胞的丰富经验。
卡西姆向记者表示,“目前CAR-T细胞疗法主要针对血液性癌症,包括儿童和成人的白血病和淋巴瘤。”
去年,伦敦大学学院和大奥蒙德街儿童医院为一名13岁的复发性T细胞白血病患者提供了碱基编辑T细胞进行治疗。这是全球首次使用碱基编辑的CAR-T细胞疗法,其中使用的碱基编辑技术则是由卡西姆领导的研究小组设计和开发。
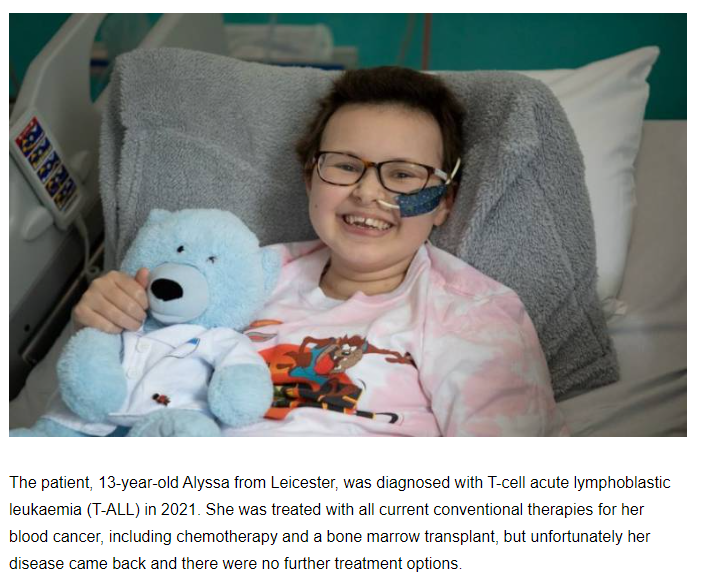
图片来源:伦敦大学学院官网截图
在提及这个案例时,卡西姆向记者表示,“去年,全球首次使用碱基编辑的CAR-T细胞来治疗耐药性白血病。这位患者情况良好,一年多后白血病就痊愈了。”
“碱基编辑是CRISPR技术的一项进步,我们现在可以用化学方法改变DNA密码的单个字母,而不是切割DNA。”他说道。与此同时,他提到了CRISPR技术在CAR-T治疗中的潜力,“CRISPR是指一种像分子剪刀一样剪断基因的新技术,它有助于改善CAR-T细胞的设计和功能。”
在传统的癌症治疗如放射治疗或化疗中,健康细胞和癌细胞无法被明显区分。这意味着,传统治疗会同时攻击两种类型的细胞,从而导致严重的副作用。相比之下,CAR-T疗法利用患者自身的免疫系统来对抗癌症,对细胞的识别更为精准。
“(改造后的)T细胞就像有生命的药物,它们不仅可以进入组织,还可以追踪逃逸正常治疗的细胞,如白血病。” 瓦西姆·卡西姆告诉《每日经济新闻》记者,“也因此,我们使用CAR-T 来治疗最难治疗的血癌。”
尽管CAR-T疗法可能代表着癌症治疗领域的极大进步,对这一疗法的广泛推广仍然还有很长的路要走。每经记者注意到,CAR-T疗法的障碍之一是T细胞功能障碍,包括细胞衰竭或衰老,这将使得它们进入人体后的工作效率降低。
例如,CAR-T细胞在输注到患者体内时也可能会出现不受控制的增殖,从而导致潜在危及生命的炎症和毒性。除此之外,同种异体CAR-T还存在较高的安全风险,例如免疫排斥和移植物抗宿主病(GVHD)等风险。
值得注意的是,今年11月28日,美国食药监局(以下简称FDA)宣布,已收到19份报告称患者在接受CAR-T治疗后患上了一种T细胞恶性肿瘤。FDA表示,目前所有靶向BCMA和CD19的CAR-T疗法都存在导致T细胞淋巴瘤的风险。该机构正在调查对相关风险进行调查,并正在评估采取监管行动的必要性。
贝勒医学院细胞和基因治疗中心的CAR-T专家马克西姆•马蒙金(Maksim Mamonkin)称,在临床试验中,继发性癌症“绝对不是经常发生,也不是我们所期望的。但当商业化产品用于成千上万的病人的治疗时,这可能会成为一个偶发性问题。”他解释道,T细胞癌症可能在患者接受化疗等其他癌症治疗后发生。如果无意中收集了癌前细胞,并将其用于CAR-T治疗,可能会导致继发性癌症。
除了以上的风险因素外,卡西姆对《每日经济新闻》记者表示,“成本、时间以及所需的特殊实验室是目前(推广该疗法)的主要障碍。不过,预计未来出现的新技术可能应该能帮助解决其中一些问题。”
据报道,为每位患者提取T细胞、对细胞进行工程改造、扩增和输注都需要相当长的时间,这意味着患者必须等待很长时间才能进行治疗。除此之外,这一过程对专业设施、科学和后勤支持提出了严格要求。
这些限制也意味着这一疗法的经济成本极高。以诺华公司的CAR-T细胞治疗技术为例,一次治疗费用为47.5万美元(约合人民币约330万元)。
据医疗市场研究出版商Kalorama Information的数据,2023年前三季度,全球细胞和基因治疗领域共融资270 亿美元,主要集中在T细胞疗法(CAR-T、TCR-T、TIL)、NK细胞疗法等方向。目前,该领域已经有超过1500家企业参与,最活跃的公司包括牛津生物医学、安斯泰来制药、武田制药、礼来、百时美施贵宝、诺华等。
其中,CAR-T细胞疗法已经展示出了巨大的市场潜力。自2017年以来,美国食品药品监督管理局(FDA)已批准六种CAR-T细胞产品用于治疗晚期复发或难治性血癌患者,分别是百时美施贵的Breyanzi及其合作疗法Abecma、强生旗下杨森和传奇生物的Carvykti、诺华的Kymriah以及吉利德科学的Tecartus和Yescarta。

图片来源:每经编辑 兰素英制图
据吉利德科学近期发布的2023年第三季度财报,Yescarta的销售额当季同比增长23%,达到3.91亿美元;Tecartus销售额同比增长18%,达到9600万美元。而传奇生物的Carvykti在美国上市的第一个年度销售额就达到了1.34亿美元。
在国内市场,今年11月上旬,合源生物CD19 CAR-T纳基奥仑赛注射液获批上市,用于治疗成人复发或难治性急性B淋巴细胞白血病。这是首款在中国获批上市的治疗白血病的CAR-T产品,也是第四款上市的CAR-T疗法。国内此前已经上市的三款CAR-T疗法分别是复星凯特奕凯达、药明巨诺倍诺达和驯鹿生物福可苏。
根据国外研究公司Precedence Research的数据,2022年全球CAR-T细胞治疗市场规模为38亿美元,预计到2032年将达到885.2亿美元左右,2023年至2032年复合年增长率将高达29.8%。
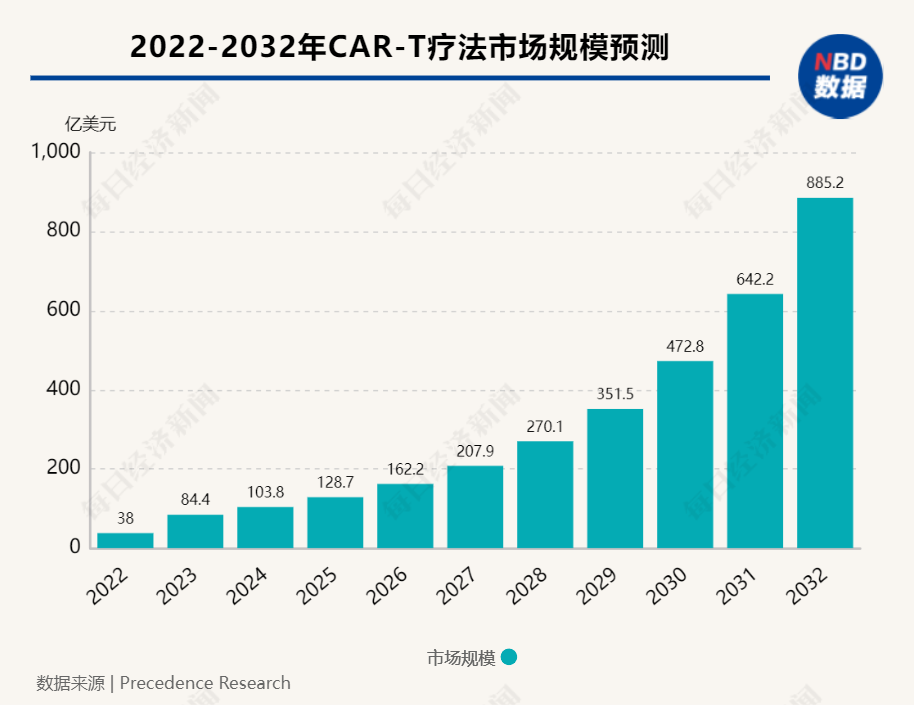
图片来源:每经编辑兰素英制图
就国内市场而言,潜力也不容小觑。据新华社,《The Lancet Haematology》发布的数据显示,2018年~2021年,国内CAR-T细胞疗法公司融资额就高达23.7亿美元。据研究机构弗若斯特沙利文预测,中国CAR-T市场规模到2030年有望达到289亿元(约合40亿美元)。
对于该技术的下一个前沿领域,纪念斯隆-凯特琳癌症中心的专家们认为,在于实体瘤领域的治疗,例如肺癌、肾癌、骨癌等等。
发表在国际医学杂志《分子治疗肿瘤学》上的一篇论文写道,CAR-T疗法治疗实体恶性肿瘤是一个令人兴奋的前沿领域,但尚未实现,且必须克服几个障碍,包括用于CAR-T细胞靶向的实体瘤抗原,(将T细胞)运输到肿瘤、肿瘤抗原的成功浸润和结合,克服 CAR-T细胞的内在因素以及可能影响该细胞效力和持久性的外在因素。
而这几个障碍中,关于实体瘤抗原的问题又最为值得关注。该论文提到,大多实体瘤中缺乏这种抗原,尽管新抗原(Neoantigen,是一类由肿瘤特异性突变产生的HLA结合肽,具有高度的免疫原性,由于它们不存在于正常组织中,因此绕过了中央胸腺耐受性)可以避免为CAR-T细胞治疗选择抗原靶点的常见问题,但它们不适用于大量患者。
此外,即使在选择了最佳抗原靶标后,CAR-T的功能也取决于防止肿瘤逃逸免疫原性表位的能力等因素,也就是说,仍然存在肿瘤逃逸的可能性。以上这些因素都是导致该疗法在实体瘤中治疗效果不佳的原因。
不过,研究人员正在探索如何改善这种疗法的安全性和有效性,例如通过改进设计或开发新的靶点。
例如,得克萨斯大学MD安德森癌症中心的胸部/头颈肿瘤内科主任John Heymach及其团队看到了该疗法在治疗小细胞肺癌上的潜力。他们近期在Cancer Cell杂志上发表的结果表明,当与靶向药物相结合时,CAR-T细胞针对耐药持久细胞表达的细胞表面蛋白,可以更有效地延迟完全耐药的出现。
“我们相信这些发现可能广泛适用于产生不同类型治疗耐药机制的其他肿瘤类型。” Heymach这样说道。
尽管仍有大量工作要做,但研究人员对CAR-T细胞疗法在实体瘤上的未来持乐观态度。“我们看到了一些非常令人鼓舞的结果,例如成功地运输和渗透到(实体)肿瘤中,以及在选定的患者中注意到显著的客观反应。”得克萨斯大学MD安德森癌症中心干细胞移植教授Samer Srour 说道。“这再次证实了CAR-T细胞在实体瘤中的应用,并提供了概念证明。”
卡西姆认为,“可能需要更长的时间才能使相同的方法适用于更复杂的癌症,并且其中一些可能会与药物或化疗结合使用。”
不过,作为细胞治疗的代表,CAR-T疗法辉煌的未来或许已经不远。
封面图片来源:伦敦大奥蒙德街儿童医院X官方账号

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
