每经编辑|卢祥勇

近日,包括淄博市第一医院在内的山东多家医院发布了《招募新型冠状病毒肺炎患者》的相关信息。

1月4日,据大河报报道,淄博市第一医院工作人员称所用药物系武汉传染病医院研发,所招募的新冠患者一人补贴4000元,共需来医院10趟,抽血3次吃药5天,检查费用全免。目前,只要符合要求的意向患者,即可前往医院。
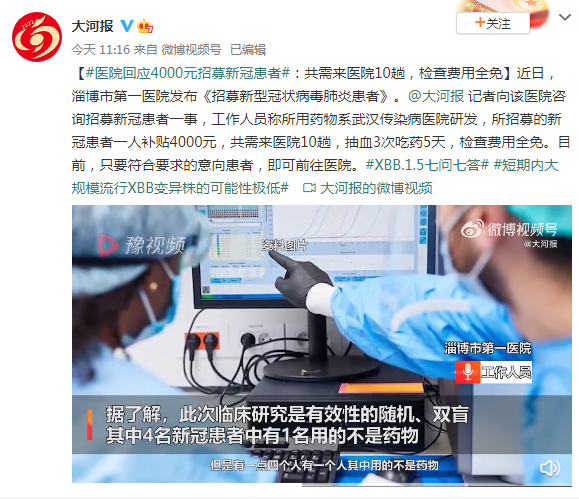

山东多家医院招募新冠患者试药
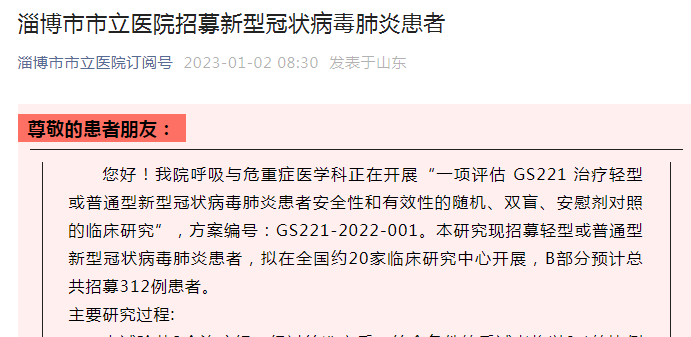
据山东淄博市第一医院微信号1月1日晚消息,淄博市第一医院发布《招募新型冠状病毒肺炎患者》称,我院呼吸与危重症医学科正在开展“一项评估GS221治疗轻型或普通型新型冠状病毒肺炎患者安全性和有效性的随机、双盲、安慰剂对照的临床研究”,方案编号:GS221-2022-001。本研究现招募轻型或普通型新型冠状病毒肺炎患者,拟在全国约20家临床研究中心开展,B部分预计总共招募312例患者。
本试验共2个治疗组,经过筛选之后,符合条件的受试者将以3:1的比例随机接受5天的GS221治疗或者安慰剂治疗,每位受试者用温水送服研究药物(GS221或安慰剂),不可咀嚼。首日口服375mg,每天一次,后续4天口服维持量125mg,每天一次,共服用5天,随访直到确认核酸转阴且临床症状全部消失或研究第14天。
淄博市第一医院表示,如果患者初步符合以下条件,请与其联系:
18≤年龄≤70周岁;
诊断为轻型和普通型患者新冠肺炎;
经核酸检测或抗原测试呈阳性;
出现咳嗽、气促或呼吸困难、发热、寒战、疲劳、身体疼痛或肌肉疼痛、腹泻、恶心、呕吐、头疼、咽痛、鼻塞、流涕、失去味觉或嗅觉任何新冠肺炎相关症状;
育龄期女性入组前妊娠试验阴性;
一个月内没有参加其他的临床试验。

1月2日,淄博市市立医院也发布了类似的招募消息,该院称:我院呼吸与危重症医学科正在开展“一项评估GS221治疗轻型或普通型新型冠状病毒肺炎患者安全性和有效性的随机、双盲、安慰剂对照的临床研究”,方案编号:GS221-2022-001。
据山东商报,近日,齐鲁制药也发布了一则旗下新冠口服药的临床试验招募广告,此次临床试验地点在山东大学齐鲁医院。每例受试者将免费接受药物治疗,研究周期为1个月。受试者无需支付研究药物及相关检查、治疗费用,并获得一定的试验补偿费。

据山东商报,淄博市第一医院工作人员称:“目前,给每一位参与临床研究的患者都提供了保险、还有试验补助。目前来看,没有明显的副作用,最好的情况下,有患者5天就能够转阴。”
据了解,目前医院正在进行的是第二批次的试验,此前已经进行过1:1试验(即入选者以1:1的比例进行盲测,1名患者服用药物,1名患者服用安慰剂),且参与临床实验的患者没有受明显的药物副作用影响。所以第二批次试验,将采用3:1的比例进行,根据消息,试验需要312人参与。
该药物距离上市还需要哪些条件?该工作人员表示,在进行完本批次的试验后,还需要再进行一次试验,才会上市。

多家新冠治疗药物研发药企招募患者
2022年12月28日晚,远大医药发布公告称,集团自主研发的创新口服小分子抗新冠病毒感染的3CL蛋白酶抑制剂GS221于2022年9月20日获国家药品监督管理局签发新药临床试验批准通知书,并迅速开展了三个相应的临床试验研究。目前已经完成的临床试验结果显示受试者用药后的安全性和耐受性良好,未观察到严重或导致停药的不良事件。
除远大医药之外,多家新冠治疗药物研发药企也在进行患者招募,包括先声药业、君实生物、科兴制药、众生药业等。
据中新经纬2022年12月28日消息,为加快江苏省新冠治疗药物上市进度,近日,江苏省药监局副局长姜伟主持召开先声药业新冠治疗药物SIM0417研究进展专题调度会。SIM0417为先声药业与中国科学院上海药物研究所、武汉病毒研究所联合开发的3CL靶点新冠治疗口服药。2022年12月16日,该项目Ⅲ期临床已完成全部1208例患者入组,进度处于国内3CL靶点药物第一位,预计最快于2023年2月上市。
另据君实生物旗下公众号“君实医学”2022年12月16日发布的文章,其中表示,在进行评价JT001(VV116)治疗轻中度新型冠状病毒肺炎受试者有效性和安全性的多中心、双盲、随机、安慰剂对照III期临床研究,全国计划入组1200例受试者。
此外,根据深圳市第三人民医院临床试验中心发布的通知,众生药业、武汉生物制品研究所、科兴制药也在近期进行阳性患者的招募。三款药物分别为RAY1216片、F61注射液和shen26胶囊。
目前,国内已有两款新冠治疗药物附条件获批上市,分别为辉瑞公司新冠病毒治疗药物Paxlovid和河南真实生物科技有限公司阿兹夫定片。其中,辉瑞公司的Paxlovid(奈玛特韦片/利托那韦片组合包装)的作用机制为3CL蛋白酶抑制剂。阿兹夫定片的作用机制是RdRp抑制剂。
编辑|卢祥勇 杜波
校对|孙志成
每日经济新闻综合自澎湃新闻、山东商报、中新经纬

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
