◎2020年,托伐普坦片全球销售额约16亿美元。恒瑞医药这一药品上市后,将与原研厂商大冢制药产品对垒。
每经记者|赵李南 每经编辑|汤辉
3月8日,恒瑞医药(600276,SH)发布公告称,其于近日收到国家药品监督管理局核准签发的关于托伐普坦片的《药品注册证书》。
《每日经济新闻》记者注意到,托伐普坦片属于利尿剂药物中的“重磅炸弹”,在该品类的几种药物中,托伐普坦片全球销售额在近年来取得了强劲增长,2020年托伐普坦片的全球销售额约16亿美元。
在国内,目前仅有浙江大冢制药有限公司的托伐普坦片获批上市。除了恒瑞医药之外,南京正大天晴和成都百裕制药也已经递交了上市申请,但尚未见到获批信息。
据恒瑞医药公告,托伐普坦(tolvaptan)是一种选择性、竞争性血管加压素V2受体拮抗剂,适用于治疗临床上明显的高容量性和正常容量性低钠血症,包括伴有心力衰竭、肝硬化以及抗利尿激素分泌异常综合征的患者;用于袢利尿剂等其他利尿剂治疗效果不理想的心力衰竭引起的体液潴留。
托伐普坦片由大冢制药开发,商品名为SAMSCA,最早于2009年5月获得美国FDA批准上市,目前已在日本、中国、欧盟等多个国家和地区上市销售。
《每日经济新闻》记者注意到,恒瑞医药对托伐普坦片的研发早于2015年。在恒瑞医药的2015年年报中,恒瑞医药披露了2015年研发项目撤回的情况,其中就包括了托伐普坦,撤回原因为“计划按照新要求完成与原研制剂的质量一致性研究后重新申报。”
2018年,恒瑞医药向美国FDA申报的托伐普坦片简略新药申请获得暂时批准。对于暂时批准的原因,恒瑞医药解释称:“虽然美国FDA已经完成该药品的所有审评流程,但存在相关专利未到期的情形。”
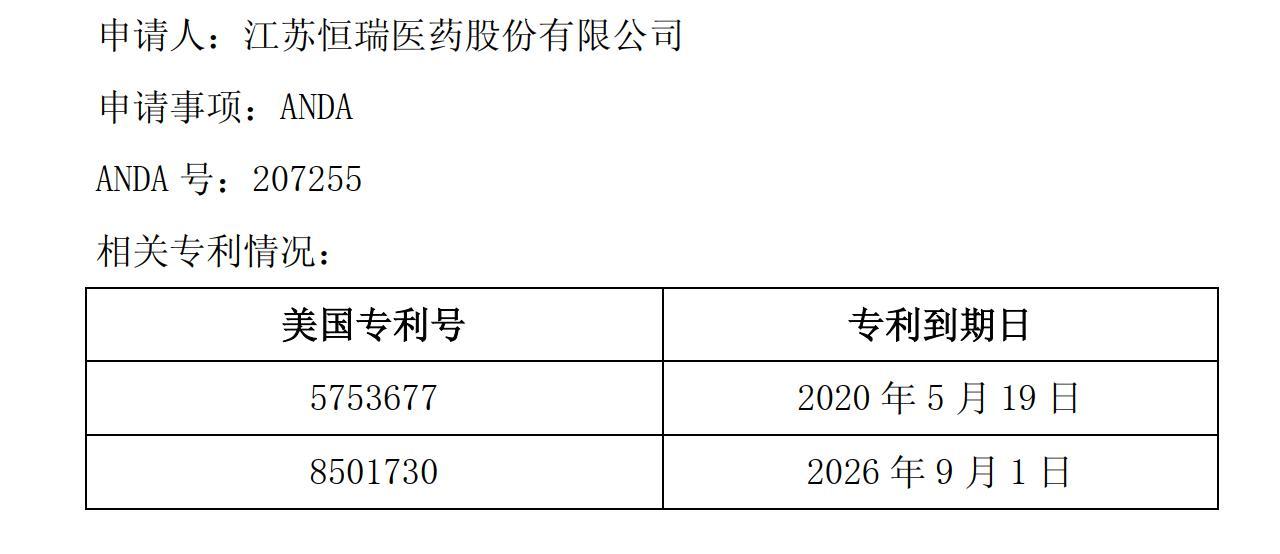
图片来源:恒瑞医药公告截图
据恒瑞医药披露,托伐普坦片在美国涉及两个专利号,到期日分别为2020年5月19日和2026年9月1日。
恒瑞医药表示:“托伐普坦片获得美国FDA的暂时批准文号,标志着该产品满足仿制药的所有审评要求,但需在相关专利到期并得到美国FDA最终批准后才可获得在美国市场销售该产品的资格。”
2019年,恒瑞医药的托伐普坦片在国内申请上市获得了实质性进展。2019年4月,恒瑞医药向国家药品监督管理局递交的药品注册申请获得受理。随后,2019年9月,恒瑞医药的托伐普坦片被国家药品监督管理局药品审评中心纳入优先审评。
至今年3月,恒瑞医药的托伐普坦片获得了《药品注册证书》。恒瑞医药表示:“截至目前,托伐普坦片此次国内申报累计已投入研发费用约为2664万元。”
此外,恒瑞医药在公告中表示:“由于医药产品具有高科技、高风险、高附加值的特点,不仅药品的前期研发以及产品从研制、临床试验报批到投产的周期长、环节多,而且药品获得证书后生产和销售也容易受到一些不确定性因素的影响。敬请广大投资者谨慎决策,注意防范投资风险。”
据湖北亨迪药业股份有限公司招股说明书,近年来托伐普坦的全球销售额增长迅猛。2014年度该药的全球销售额为2.43亿美元,至2018年增长至了8.12亿美元。同时,按照2018年度销售额计算,托伐普坦也是利尿剂大类中的第三大品种。

图片来源:湖北亨迪药业股份有限公司招股书截图
恒瑞医药在公告中称:“经查询EvaluatePharma数据库,2020年托伐普坦片全球销售额约为15.77亿美元。”换句话说,2020年托伐普坦片全球销售额约为2014年的6.5倍。
药智网数据显示,浙江大冢制药有限公司的托伐普坦片近两年在各省的中标价为495元/盒(15mg规格)和841.5元/盒(30mg规格)。
据浙江大冢制药有限公司的药品说明书,以托伐普坦片日口服剂量15mg~60mg和上述中标价进行估算,目前托伐普坦片每月治疗费用约为3000元至10000元。
药智网临床试验数据库显示,成都倍特药业股份有限公司“托伐普坦片人体生物等效性试验”状态为“进行中(尚未招募)”。
恒瑞医药在公告中称:“目前国内除公司外,仅浙江大冢制药的产品获批上市,另有南京正大天晴和成都百裕制药2家递交了上市申请,未见获批信息。”
封面图片来源:摄图网

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
