◎《掘金创新药》研究员认为,三年亏去超60亿元后,科济药业亟需一款重磅商业化产品。另外,尽管CAR-T疗法有望成为肿瘤后线治疗颠覆性疗法,但由于价格高昂、供货时间长、潜在适用群体有限等诸多限制,CAR-T疗法在商业化的道路上能走多远仍有待观察。
◎沃艾可欣能给沃森生物带来多少业绩增量尚难以预料,其何时能在国内获批上市也存在变数。对沃森生物来说,公司在mRNA技术路线布局的新冠疫苗取得了一定成果;而布局mRNA技术与平台所取得的积累,也将为公司后续多种mRNA疫苗提供经验借鉴。
每经记者 陈浩 每经编辑 魏官红
《掘金创新药》由每日经济新闻联合药渡数据共同推出,旨在解读新药研发进展与趋势,剖析产品竞争力与市场前景,洞察医药资本脉络,见证医药产业高质量发展。
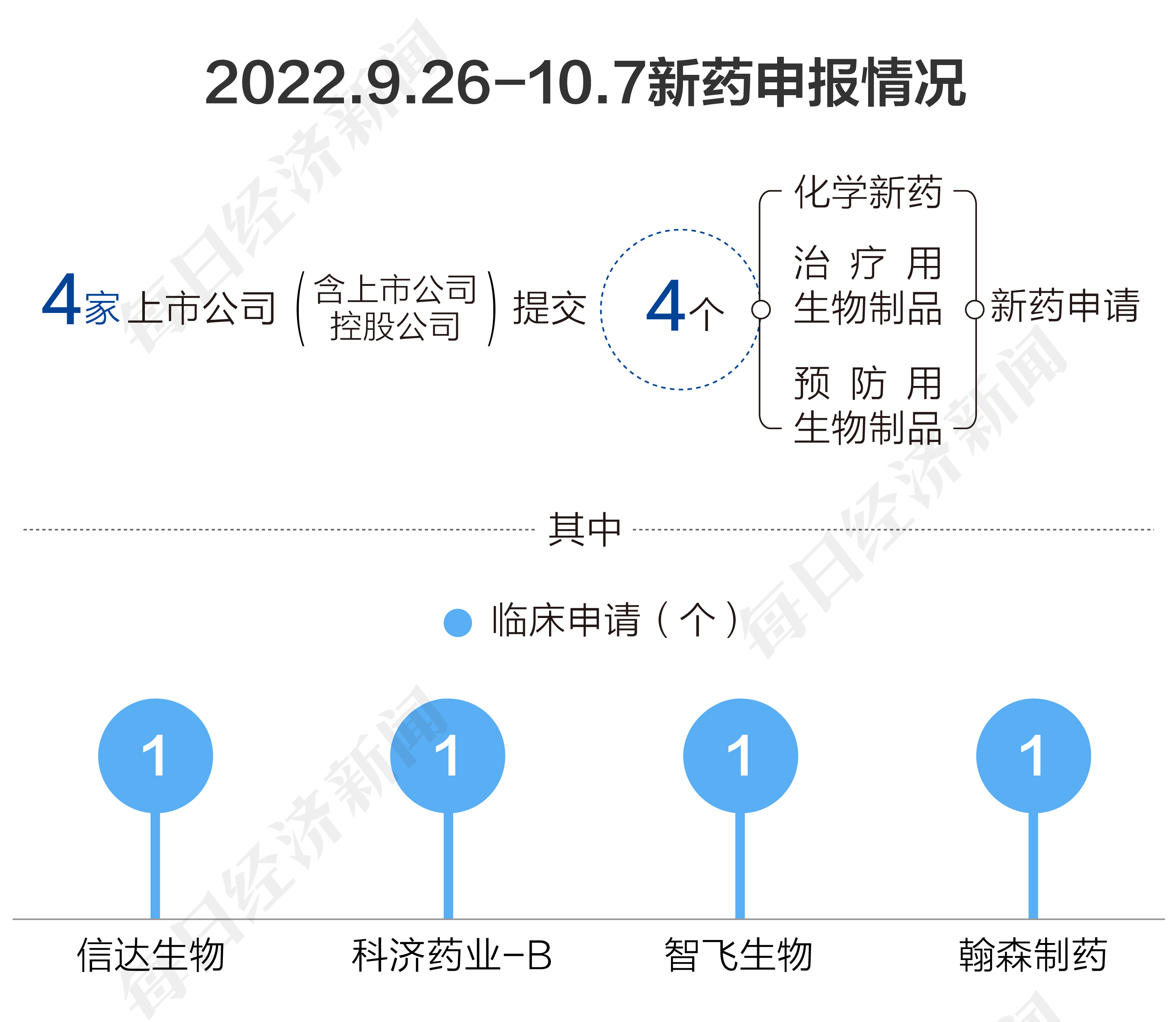
根据药渡数据,2022年9月26日至2022年10月7日期间,国家药品监督管理局药品审评中心(CDE)共收到4家上市公司(含上市公司控股公司)提交的4个化学新药、治疗用生物制品、预防用生物制品新药申请。

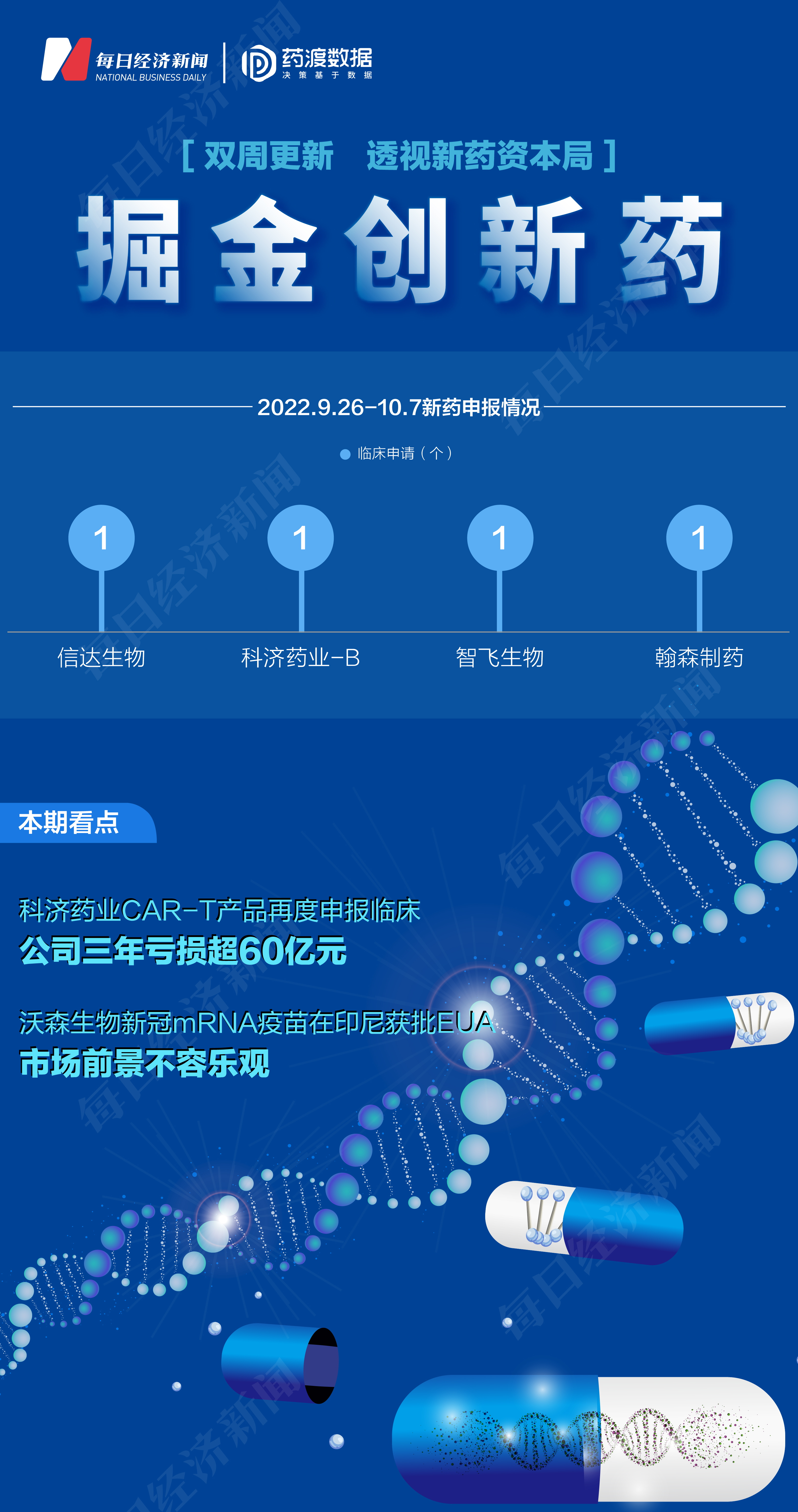
2022年9月26日至2022年10月7日期间,上市公司方面,信达生物(HK01801,股价22港元,市值337港元)、科济药业-B(HK02171,股价9.6港元,市值55亿港元)、智飞生物(SZ300122,股价79.54元,市值1273亿元)、翰森制药(HK03692,股价11.42港元,市值676亿港元)各提交1个临床申请。
1.科济药业拟治疗实体瘤CAR-T产品再度申报临床,仍在等待首款商业化产品
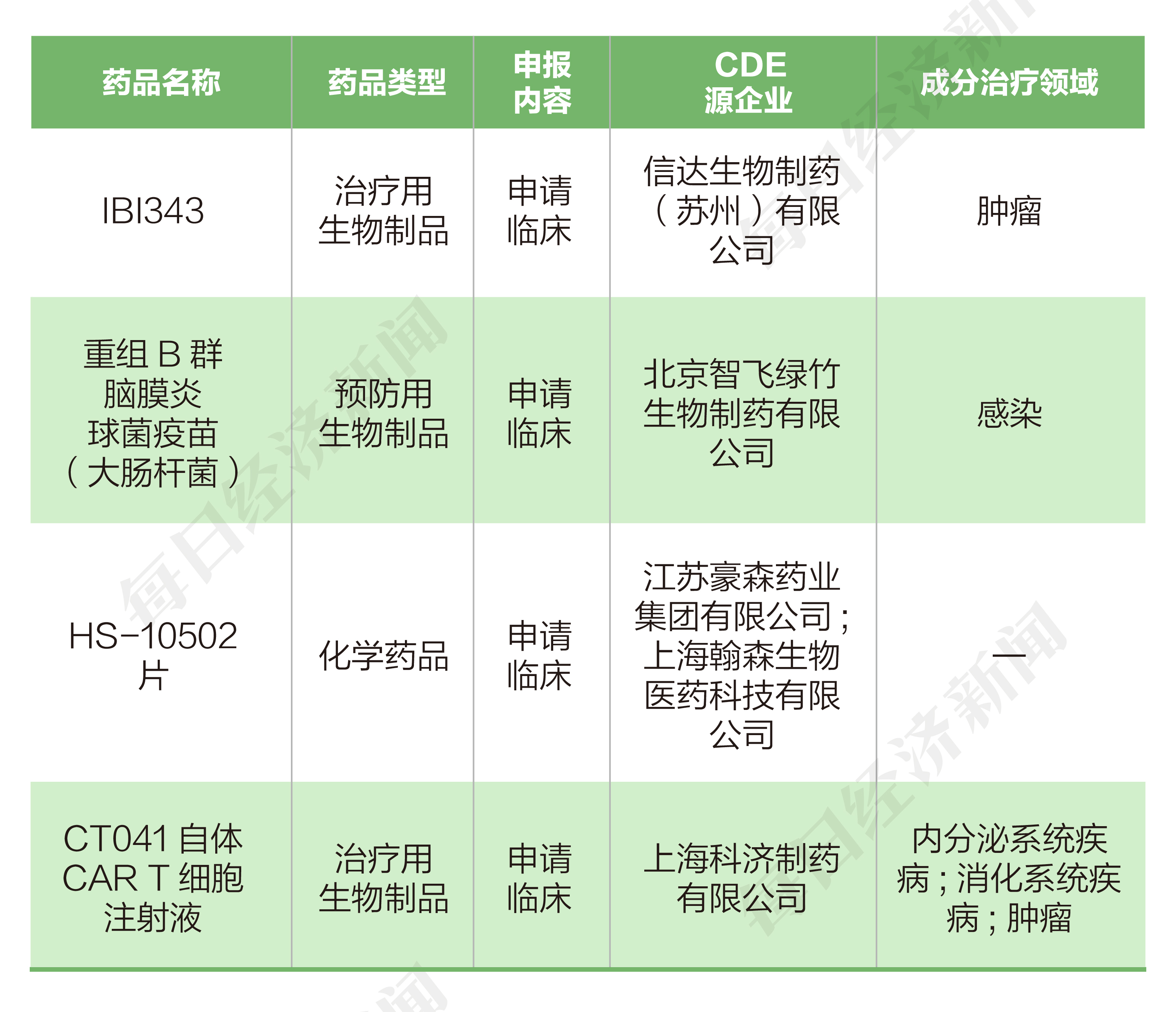
9月28日,CDE官网显示,科济药业-B的“CT041自体CAR T细胞注射液”(以下简称“CT041”)再度申报临床。据公司介绍,CT041是一种潜在全球同类首创的、靶向CLDN18.2蛋白质的自体CAR-T细胞候选产品,拟用于治疗CLDN18.2阳性实体瘤,主要治疗胃癌/胃食管结合部癌及胰腺癌。
据悉,CT041已于2020年获得FDA授予的孤儿药资格认定;于2021年获得欧洲药品管理局(EMA)授予的优先药物(PRIME)资格,用于治疗晚期胃癌;于2022年获FDA授予再生医学先进疗法(RMAT)资格,用于治疗CLDN18.2阳性的晚期胃癌/食管胃结合部腺癌。今年年初,CT041获得国家药监局批准,进入确证性II期临床试验,成为全球首个进入确证性II期临床试验的用于治疗实体瘤的CAR-T产品。
行业洞察:
根据国盛证券研报,全球CAR-T疗法市场已从2017年的0.1亿美元提升至2020年的11亿美元,并将在2024年达到66亿美元,2030年将提升至218亿美元。此外,据弗若斯特沙利文测算,2030年中国CAR-T疗法市场将增至289亿元。
目前,全球共有8款CAR-T产品获批上市,适应症均为血液肿瘤。在针对实体瘤的CAR-T疗法领域,科济药业率先布局,已有多个CAR-T产品处于临床试验阶段,在全球实体瘤CAR-T研发领域处于领先地位。上述国盛证券研报指出,统计数据表明,癌症患者中实体瘤群体占比达90%,相比血液瘤市场空间更加可观,CAR-T疗法有望成为实体瘤末线颠覆性疗法,但高昂的价格是其应用主要障碍。
靶点上,科济药业的CT041靶向Claudin18.2,该靶点在胃癌、胰腺癌中高度特异性表达,是理想的开发靶标,胃癌、胰腺癌也是CT041正在开展临床试验的适应症。据悉,科济药业是全球首个成功识别、验证和报告CLDN18.2可作为CAR-T治疗靶点的公司。此前,靶向Claudin18.2的药物已经囊括了单抗、双抗、ADC等技术路线。
在2022年ASCO大会上,科济药业展示了两篇关于CT041研究结果的海报,包含临床试验的相关数据。公司称,CT041有可能在未来成为胃癌/食管胃结合部腺癌和胰腺癌的骨干疗法,并惠及全球大量患者群体。
公司点评:
自2014年正式运营以来,科济药业专注于血液瘤和实体瘤的创新CAR-T细胞疗法。目前,科济药业尚无商业化产品获批,2019年至2021年,公司分别亏损2.65亿元、10.64亿元和47.44亿元,三年合计亏损超60亿元。今年上半年,公司亏损3.76亿元,同比有所收窄。
截至2022年6月30日,科济药业现金及现金等价物以及短期投资为27.4亿元,较2021年末的30.07亿元减少2.67亿元,公司称主要由于研发开支、行政开支及资本支出投入所致。
对科济药业来说,在研管线中的CT053和CT041未来能否顺利实现商业化尤为关键。公司称,预计CT053于2022年第三季度向国家药监局提交上市申请,并计划于2023年向FDA提交上市申请。对于CT041,公司称预计于2024年上半年在国内提交上市申请。
《掘金创新药》研究员认为,三年亏去超60亿元后,科济药业亟需一款重磅商业化产品。另外,尽管CAR-T疗法有望成为肿瘤后线治疗颠覆性疗法,但由于价格高昂、供货时间长、潜在适用群体有限等诸多限制,CAR-T疗法在商业化的道路上能走多远仍有待观察。
2021年10月至今,科济药业股价持续下跌,目前股价较高点已经跌去八成。对于专攻CAR-T疗法的科济药业来说,即使未来旗下CAR-T产品顺利获批上市,如何大规模商业化推广也是不容忽视的问题。
2.沃森生物新冠mRNA疫苗在印尼获批紧急使用授权 新冠疫苗市场空间还有多大?
9月30日,沃森生物(SZ300142,股价38.16元,市值613亿元)发布公告称,公司及子公司研发的新冠mRNA疫苗(商品名:沃艾可欣/AWcorna)获得印度尼西亚国家食品药品监管局批准的紧急使用授权(EUA),其也是国内自主研发的首个获批海外上市的新冠mRNA疫苗。
据悉,沃艾可欣于2020年6月获得国家药监局批准进入临床研究,并于2021年9月正式开展在空白人群中的关键注册III期国际多中心保护效力临床试验,分别在印度尼西亚、墨西哥和菲律宾三个国家共计入组20812例受试者。本次EUA批准该产品用于18岁及以上无新冠疫苗接种史的人群进行两剂接种,或用于18岁及以上完成新冠灭活疫苗基础免疫的人群接种一剂作为序贯免疫加强。
行业洞察:
到今年10月,国内累计接种新冠病毒疫苗超34亿剂次。国内已有9款新冠疫苗获批附条件上市或紧急使用许可,不过,国内目前尚无新冠mRNA疫苗获批,沃森生物的沃艾可欣是全球第三款上市的新冠mRNA疫苗。
根据界面新闻报道,到今年9月,印尼加强针接种率为26.37%。沃森生物在公告中称,印度尼西亚是世界第四人口大国,疫苗市场空间广阔。公司表示,沃艾可欣在国内的Ⅲ期临床研究阶段现场工作已基本结束,但何时能够获批尚无定数。
公司点评:
今年上半年,沃森生物实现营收23.48亿元,同比增长73.96%,归母净利润为4.21亿元,同比增长31.90%。公司上半年二价HPV疫苗共获得批签发884664剂,13价肺炎结合疫苗批签发量同比增长39.68%。
对于最近在印尼获批紧急使用授权的沃艾可欣来说,其市场空间还有多大?今年7月,香港大学生物医学学院教授金冬雁在电话中对《掘金创新药》研究员表示,新冠疫苗产能过剩是肯定的,整体市场空间会越来越小。不过,金冬雁也提到,未来新冠疫苗很可能变成季节性接种,变成每年接种一次或每两年接种一次。
《掘金创新药》研究员认为,沃艾可欣能给沃森生物带来多少业绩增量尚难以预料,其何时能在国内获批上市也存在变数。mRNA技术是生物医药未来重要的发展方向之一,对公司来说,沃艾可欣获批紧急使用授权,标志着公司在mRNA技术路线布局的新冠疫苗取得了一定成果;而布局mRNA技术与平台所取得的积累,也将为公司后续多种mRNA疫苗提供经验借鉴。
封面图片来源:摄图网-500448297

1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
