12月13日,信达生物的单抗注射液“信迪单抗”上市申请,获得国家食品药监局药品中心受理,成为首个申请上市的国产PD-1单抗。2016年9月13日,信迪单抗获得国家食品药监总局颁发的药物临床试验批件,2017年5月,进入临床III期,半年后的今天,该产品已经申请上市。“信迪单抗”临床试验进展之快,恐怕已经令国内其他PD-1/PD-L1抗体研发企业感觉到压力。
“抗癌神药”取得最新进展。
12月13日,信达生物的单抗注射液“信迪单抗”上市申请,获得国家食品药监局药品中心受理,成为首个申请上市的国产PD-1单抗。
在新三板,市值超百亿的君实生物(833330),其正在重点研发的药物也是PD-1单抗。可见药品虽好,但竞争同样激烈。
“信迪单抗”也是继国外的百时美施贵宝(BMS)Opdivo之后,第2个申请中国上市的PD-1/PD-L1药物。
PD-1/PD-L1免疫疗法,是目前除了常见的治疗手段如手术、放化疗和靶向药治疗等之外的最新的癌症治疗方法。
它的作用就是阻断肿瘤细胞和T细胞结合,使“人体卫士”T细胞能正常发挥在人体内的作用,持续识别出人体的肿瘤细胞并进行清除。由此PD-1/PD-L1药物被称为“抗癌神药”。
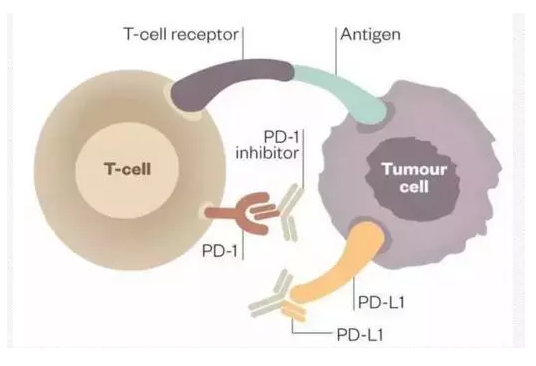
据悉,信迪单抗注射液申请适应症为霍奇金淋巴瘤。除此适应症之外,它还在进行非小细胞肺癌、食管癌以及NK/T细胞淋巴瘤临床研究,主要用于治疗晚期实体瘤。
2016年9月13日,信迪单抗获得国家食品药监总局颁发的药物临床试验批件,2017年5月,进入临床III期,半年后的今天,该产品已经申请上市。
“信迪单抗”临床试验进展之快,恐怕已经令国内其他PD-1/PD-L1抗体研发企业感觉到压力。
据悉,目前全球共有5个PD-1/PD-L1类药物上市。目前最畅销的PD-1免疫检查点抑制剂Opdivo的2015年销售额为9.42亿美元,2016年销售额37.74亿美元,2017年前三季度销售额35.87亿美元。
有分析预计,随着适应症的不断拓展,PD-1抗体药物的销售额可能实现数倍或数十倍增长。
同行的“抗癌神药”申请上市了,新三板公司君实生物也在加急研发。
君实生物是创新层企业,拥有7个做市商。10月份,该股出现了一波强劲上涨的行情,最新(10月24日)收盘价报19.02元,以此计算该公司市值达111亿元。
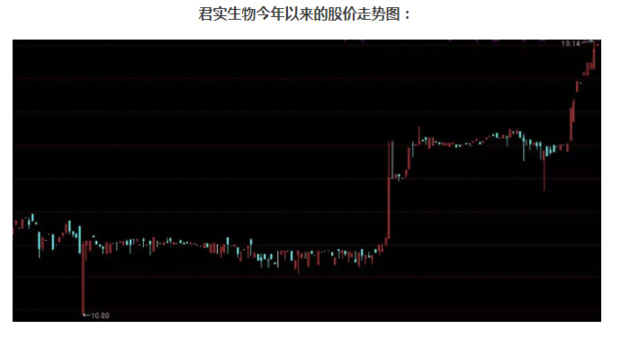
对于这家连年亏损的新药研发公司来说,投资者追捧的,无疑是其研发的“抗癌神药”。
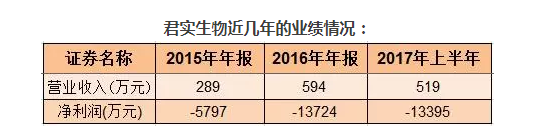
君实生物主营业务为单克隆抗体药物的研发与产业化,拥有十多个在研品种。公司重点开发的第一个新药——重组人源化抗PD-1单克隆抗体注射液(JS001)目前已经进入II期临床试验。
在今年的半年报中,该公司称正重点推进JS001、UBP1211等项目的临床试验,加快产业化进程,力争JS001、UBP1211项目早日上市销售,从而为公司带来稳定的现金流。
与信迪单抗注射液适应症不同,君实生物的JS001,主要用于黑色素瘤、尿路上皮癌、胃癌、头颈癌和肺癌等恶性肿瘤的治疗。
2015年挂牌新三板时,君实生物预计JS001将于2016年取得药物临床试验批件,2020年产品上市销售。实际上在2015年12月,公司该药物获得了药物临床试验批件。
2017年上半年,在取得I期临床试验阶段性成果后,该公司开始相继开展黑色素瘤、尿路上皮癌、胃癌、食管癌、头颈癌、鼻咽癌等适应症的II期临床试验。
在挂牌时君实生物曾介绍过,与公司JS001同靶点的药物是默沙东的Pembrolizumab和百时美施贵宝的Nivolumab(Opdivo),这两项药物已于2014年先后在美国上市。
从治疗成本来看,君实生物认为,竞争产品Opdivo和Pembrolizumab年治疗费用近15万美元,JS001相对较低的治疗费用更具有优势。
君实生物曾表示,竞争产品Opdivo和Pembrolizumab进入国内市场需要3年-5年的时间。这两项药物均于2014年上市。
而根据最新的消息,11月2日,百时美施贵宝已经申请PD-1单抗Opdivo在中国上市。
分析认为,鉴于Opdivo是临床获益非常显著的创新药,如果参考阿斯利康AZD9291的中国上市申请历时不到2个月的审批速度,Opdivo很有希望在2018年初获得国家食品药监总局批准。
从国内研发企业看,正在开发与JS001同靶点的药物还有恒瑞医药,其与君实生物一样处于临床试验阶段。资料显示,恒瑞医药的PD-1药物camrelizumab处于临床III期,其用途包括食管癌等。
按照信迪单抗的速度,恒瑞医药PD-1药物也有望紧随其后申请上市。
据悉,单抗创新药从基础研究发现成果,到产品获准上市销售通常需要10年时间,而从临床前研究到上市,一般需要5-10年时间。
不过有研究资料表示,新药从II期临床试验到临床III期,有可能存在失败的风险。
君实生物也坦言,由于进入II、III期临床试验情况更复杂、不确定性增加,尽管公司设计的临床试验方案符合国家食品药监总局有关法规的规定,并符合专业与统计学设计要求,但临床试验方案实施效果仍有可能低于预期。
据业内人士介绍,从临床III期到审批上市,大约需要三年的时间。这意味着,如果要按计划推动JS001产品在2020年上市销售,君实生物需要加速推动该药物的研发进度。
新药的投资具有时间长、风险大、阶段性资金需求重大的特征,资金的投入贯穿了整个研发流程,所需的资金数以亿计。
在停牌前的10月16日,君实生物抛出了非公开发行5亿元的双创可转债方案,其中计划使用2亿元募资投向JS001临床试验项目。据悉,该项目计划投资总额为10亿元。
据公司介绍,这2亿元将用于包括黑色素瘤、鼻咽癌、膀胱尿路上皮癌、三阴乳腺癌、肾细胞癌、胃癌、食管鳞癌、头颈部鳞癌等适应症II期、III期临床试验,以加快JS001上市步伐。
另外,12月13日君实生物还公告,2015年至2016年的三次定增,将部分募集资金用途进行变更,用于增加投入JS001临床研究以及产业化基地项目,目的都是为了加快JS001上市步伐。
来源:新三板论坛 记者:梁秋燕

