12月7日,上海市食药监局发布并实施《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》,先行先试医疗器械注册人制度创新改革。这一试点启动后,符合条件的医疗器械注册申请人可以单独申请注册证,然后委托给有资质和生产能力的生产企业,从而实现产品注册和生产许可的“松绑”,让创新成果更易问世。
每经编辑 张韵

每经记者徐杰 每经实习记者 张韵 上海摄影报道
每经编辑 杨欢
在上海奥普生物医药有限公司(下称“奥普生物”)的试剂工艺实验室里,一名医药工作人员正将实验数据录入电脑;而进入仪器装配空间,两名机械工作人员正在进行精密零件的人工组装。
工作人员告诉《每日经济新闻》记者:“一件诊断医疗器械产品从研发到上市要经历机械、软件和电器开发,样品通过临床验证才可向上海市药监局申请注册,之后依据生产条件取得生产许可证才能投入量产,通过原材料采购、零件装配、部件装配、总机装配、质量检验方可搭配试剂上市销售。”
这套原先必须在同一家公司完成的“组合拳”,现在终于可以将其中的生产环节委托给拥有医疗器械生产资源的企业“代为加工”,免去折腾硬件的烦恼,这得益于近日开始实施的《中国(上海)自由贸易试验区内医疗器械注册人制度试点工作实施方案》(下称“《方案》”)。
医疗器械注册人制度图解:从“捆绑”到“解绑”
这是上海自贸区“证照分离”改革2.0版的一项新举措。从1.0版到2.0版,上海自贸区仅用了不到两年。
12月12日,《每日经济新闻》记者来到未来全球科创中心腹地、医疗器械硅谷——位于上海浦东张江东区的现代医疗器械园,在这里了解到,目前已有企业开始商议推进试水项目。
捆绑

奥普生物质造中心高级总监张学红在该领域拥有十多年工作经验,对医疗器械的管理规范非常熟悉。
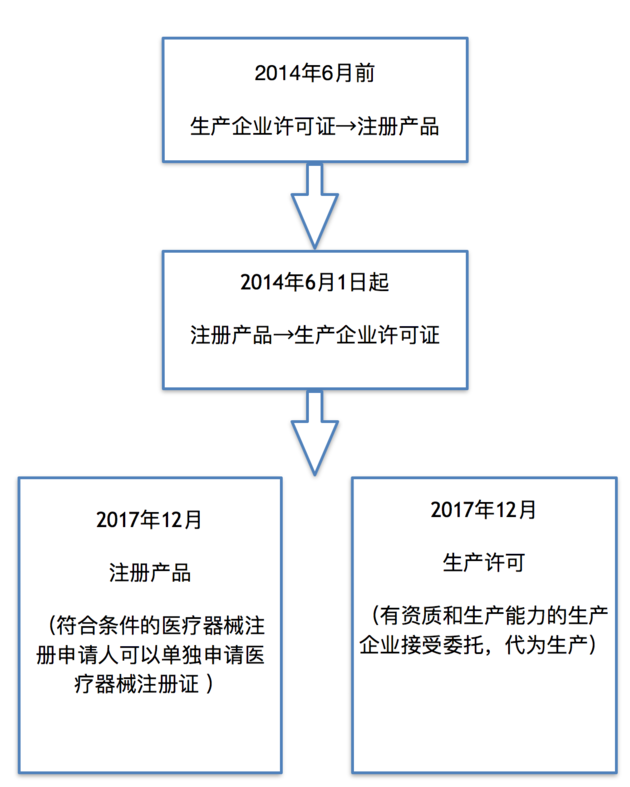
她告诉《每日经济新闻》记者,目前医疗器械行业的“最高监管大法”还是2014年全面修订的《医疗器械监督管理条例》(下称“《条例》”),该条例颁布后,产品注册与生产场地许可的次序发生了变更,从必须先办理生产企业许可证再注册产品,转为可先注册产品再办理生产许可。
“也就是说,原先可以一次性拿到生产企业许可证再申请产品注册的模式,在2014年之后需要以产品为单位,依次取得注册和许可两次证明,这样做虽然可以让科研创新企业不必将前期资源消耗在生产厂房的投资上,但对专业从事于器械生产的企业来说要求更加严格了。”张学红表示。
她举了两个典型的案例,2014年前专注研发的透景生命花费2年多时间、耗资3亿元自己建设工厂,费时又费力;2014年后专注代工业务的捷普科技面临接不到国内订单的难题,这也是很多医疗器械企业面临的痛处。
解绑
“而新《方案》的实施是以《条例》为基础,将产品注册和生产许可进行解绑”,张学红分析道,这更有利于社会分工。
据了解,所谓医疗器械注册人制度,是指符合条件的医疗器械注册申请人可以单独申请医疗器械注册证,然后委托给有资质和生产能力的生产企业生产。
张学红认为,对于有研发能力的小微企业来说,一方面生产管控能力并非一朝一夕便可形成,另一方面医疗器械在生产端的投入很高,所以《方案》实行后,在硬件方面的解放会比较大。
一年多以前,上海试点药品上市许可持有人制度,截止2017年5月,在381例的注册试点中,研发机构申报占比56%,大大激发科研热情。正如药品上市许可持有人制度的核心是实现药品上市许可证和生产许可证的分开,让药品可代工生产。医疗器械注册人制度,与其有异曲同工之妙。
作为目前首个试点医疗器械注册人制度的地区,上海也将进一步探路医疗器械的制度革新,继续为全国提供先行经验。
切块

“说实在的,《方案》的实施将会使我们孵化器旗下的医疗器械创新企业更多受益。”奥普生物是一家专注于POCT的试剂仪器研发、生产、转化与销售为一体的国家高新技术企业,要是立足于企业本身,影响并不会过于显著。
但是张学红仍在积极寻找新制度带来的空间活力。巧合的是,12月12日,从事于专业医疗孵化的上海衍禧堂创始人翟靖波来到奥普生物,双方计划一起探讨试水旗下孵化企业委托生产的相关事宜。
《每日经济新闻》记者了解到,国内对体外诊断试剂的硬件条件非常高,而奥普生物具备净化车间和药品的生产资源,正在考虑如何与有此类需求研发成功的孵化类企业达成委托关系,盘活产能。
根据奥普生物从事医疗器械领域20年的经验来看,从设计开发到验证、注册、许可、上市,再经历生产、销售、使用的整个生命周期循环,每个环节在药监上都有一套严格的管理体系。
张学红表示,将医疗器械全生命周期“切块”让专业的主体做专业的事,最大的好处就是可以激发注册人的创新活力。正所谓“术业有专攻”,通过这种方式,产品问世的速度将有所增加。
担责
值得注意的是,在10月31日,食品药品监管总局办公厅公开征求《〈医疗器械监督管理条例〉修正案(草案征求意见稿)》意见。草案征求意见稿对现行《条例》增加8条,修改19条。
其中修改内容包括完善医疗器械上市许可持有人制度。在第二章“医疗器械产品注册与备案”中设专条规定注册人和备案人的条件以及应当履行的具体义务。
同样,此次《方案》对注册人在条件设定和能力审评上都提出了明确的要求,也规定医疗器械注册人必须具备对上市医疗器械全生命周期管理的能力,对医疗器械设计开发、临床试验、生产制造、销售配送、售后服务、产品召回、不良事件报告等承担全部法律责任。
这意味着,产品无论是自我生产还是委托生产,注册人在整个产品生命周期中都要承担其作为上市许可持有人的主体责任,履行应尽的义务。
严管
另外,注册人和受托企业之间必须签订委托合同和质量协议。
对此,张学红表达了自己的观点:“这对注册人和受托企业都提出了更高的要求,因为模式从企业内部交接到外部转移的变化使得双方企业在内部技术转移体系、双方法律责任规定、受托方的生产质量责任等方面都需要清晰落实管理责任。”
从目前公布的《方案》来看,上海食药监局在打开生产“枷锁”、鼓励创新的同时,对监管也作出了更为严格的要求。
一方面,对委托方本身进行管理,要求其主动上报医疗器械不良事件,并建立追溯系统。另一方面,加强跨区域监管和强化上市后监管,并引入第三方协同管理,不给投机人或“僵尸公司”钻空子的机会。
初步统计,自贸区内已有20多个医疗器械品种计划申报。医疗器械注册人制度的建立,不仅有助于医疗器械早日上市,也有利于创新研发力量在上海的集聚,推动医疗器械产业链上下游分工与合作,提升产业能级,形成先进制造优势,促进高端医疗器械本土生产。


1本文为《每日经济新闻》原创作品。
2 未经《每日经济新闻》授权,不得以任何方式加以使用,包括但不限于转载、摘编、复制或建立镜像等,违者必究。
